방사성 붕괴는 방사성 원소를 포함하는 물질의 물리∙화학적 상태에 관계없이 항상 일정한 비율로 일어났다. 그것은 전체 질량의 반이 붕괴하는 데는 항상 같은 시간이 걸린다는 것을 뜻했다. 러더퍼드와 소디는 방사성 붕괴의 과정은 확률을 통해서만 설명될 수 있다는 것을 발견했다. 모든 방사성 원소가 1년 안에 붕괴할 확률이 1/2로 같다면, 방사능 원소의 양에 관계없이 1년이 지나면 방사성 원소의 양이 반으로 줄어들 것이기 때문이다.

그러나 그런 일이 일어나기 위해서는 모든 원자가 똑같은 붕괴 확률을 가지고 있어야 하고, 붕괴 확률이 외부적 환경 변화나 시간의 흐름에 따라 변하지 말아야 한다. 모든 원자의 붕괴확률이 같다는 것은 원자가 나이를 먹지 않는 것을 뜻하는 것이었다. 예를 들면, 사람은 나이를 먹는다.
따라서 50세인 사람이 다음 10년 동안에 죽을 확률과 80세인 사람 이 다음 10년 동안에 죽을 확률은 일반적으로 같지 않다. 그러나 실험결과 원자는 시간의 흐름에 따라 나이를 먹지 않을 뿐만 아니라, 아무리 험한 환경에서도 더 빨리 늙거나 노쇠해지지 않았다. 그것은 원자 속에 원자핵이 있다는 것과 방사성 붕괴는 원자 깊숙이 숨어 있는 원자핵에서 일어나는 일이어서 물리∙화학적 환경의 변화가 영향을 주지 못한다는 것을 알아낼 때까지는 풀 수 없는 수수께끼였다.
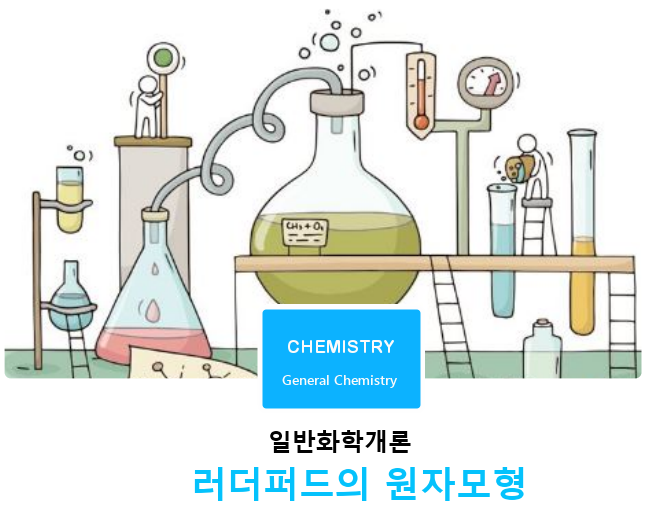
α 입자 산란 실험을 통해 원자핵의 존재를 발견한 러더퍼드는 (+)전하를 띠는 양성자들이 원자핵 안에 빽빽하게 들어있고, 그 주위를 전자가 돌고 있는, 마치 행성이 태양 주위를 도는 것과 같은 모형을 제시했다. 러더퍼드의 모형에 따르면 원자 질량의 대부분은 아주 작은 부피의 원자핵이 차지하고 있으며 원자의 대부분은 비어 있다. 러더퍼드의 모형은 자신의 α 입자 산란 실험 결과와 잘 맞아 떨어지지만, 전자 궤도의 안정성을 설명할 수 없었다.
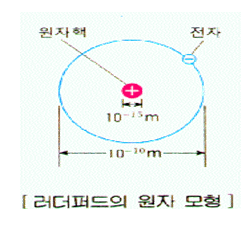
이 원자모형을 주장하게 된 α 입자 산란 실험에 대해서 좀 더 자세히 살펴보자. 대부분이 러더퍼드가 직접 실험을 하였다고 알고 있지만, 실제로 그 실험을 한 사람들은 그의 조교였던 어니스트 마르스덴과 한스 가이거였다. 그들은 금을 얇게 펴서 두께가 20,000분의 1cm인 금박을 만들었다. 다른 금속이 아닌 금을 사용한 것은 금의 가공성이 좋아 얇은 막을 만드는데 적당했기 때문이었다. 금박을 만든 후에는 방사성 원소에서 나오는 알파입자(He2+)를 이 금박을 향해 발사했다. 발사라고는 하지만 실제로는 납으로 된 용기 속에 우라늄이나 라듐과 같은 방사성 원소를 넣고 금박을 향해 입구를 열어 놓는 것이 전부였다.
그러나 방사성 원소에서 나온 알파입자는 초속 약 16,000km의 속력으로 금박을 향해 달려가기 때문에 발사라는 말을 사용해도 큰 무리가 없다. 금박 뒤에는 알파입자가 부딪혔을 때 작은 불꽃을 내는 황화아연 스크린이 있었다. 마르스덴과 가이거는 어두운 실험실에서 알파입자가 내는 작은 불꽃의 위치와 수를 기록했다. 이 작업을 통해 그들은 놀랍게도 알파입자 중의 일부가 금박을 통과하지 못한다는 것을 알게 되었다. 약 8,000개의 알파입자 중 하나 정도는 뒤쪽으로 튀어나왔다.
그것은 놀라운 사실이었다. 초속 16,000km로 달리는 입자가 20,000분의 1cm밖에 안 되는 금박을 통과하지 못한 것은 총알이 얇은 휴지를 뚫지 못하고 다시 튀어나온 것과 같은 사건이었다. 무엇이 알파입자와 충돌하여 알파입자를 뒤로 튕겨나가게 하였을까? 작은 전자일 수는 없었다. 그것은 매우 무겁고 단단해야 하고 다가오는 알파입자를 튕겨 나가게 할 만큼 많은 전하를 가지고 있어야 했다. 당시 러더퍼드가 알고 있던 원자모형, 즉 그의 스승인 톰슨이 주장한 원자모형이라면 알파입자가 가벼운 전자를 흩어버리고 원자를 그대로 통과했어야 했다.
그러나 실험결과는 예상과 달랐다. 그것은 톰슨의 원자 모형이 옳지 않다는 것을 의미했다. 이 실험결과를 토대로 러더퍼드가 만들어낸 새로운 원자 모형에는 원자들이 원자핵을 가지고 있고 전자들은 원자핵 주위를 빠른 속도로 돌고 있었다. 아직 중성자가 발견되지 않았던 때라 원자핵의 구조를 제대로 설명할 수는 없었지만, 원자핵의 존재는 정확하게 알아낸 것이다.
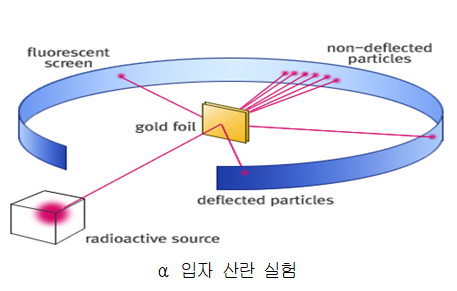
아래 그림은 α 입자가 튕겨져 나오는 모습을 보여주고 있다.
이제는 러더퍼드 원자모형의 장․단점을 따져보려고 한다. 가장 큰 장점은 원자핵의 발견이다. 원자핵이 우리가 알고 있는 원자보다 엄청나게 작다는 것을 알게 되었고, 그에 의해 (+)전하를 가진 무거운 원자핵과 그 주위를 돌고 있는 (-)전하로 이루어진 가벼운 전자로 구성되는 원자 모형이 정립되었다.
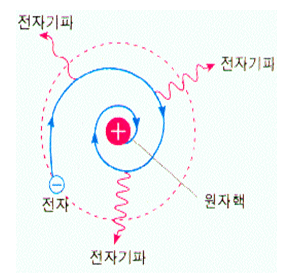
하지만, 원자핵과 그 주위를 돌고 있는 전자라는 원자모형이 만들어지자 엄청난 문제가 발생했다. 전자가 원자핵주위를 돌기 위해서는 원운동이나 타원운동과 같은 가속운동을 해야 한다. 그런데 전자는 전하를 띠고 있으므로 가속운동을 하면 전자기파를 발생시킨다. 발생하는 전자기파는 당연히 에너지를 가지고 있을 것이고 이 에너지만큼 전자의 에너지는 줄어든다.
따라서 전자는 잃은 에너지만큼 원자핵에 점점 가까워지고 결국에는 원자핵과 충돌하여 소멸하게 된다. 결국 원자는 존재할 수 없다는 결론이 나온다. 이론적으로 전자가 원자핵에 흡수되는 시간은 매우 짧은 시간이므로 안정된 원자는 존재할 수 없다. 분명 원자가 존재하고 있는데 만들어진 원자모형으로는 존재할 수 없다는 엄청난 문제가 발생한 것이다.
이 문제가 바로 에너지 미 방출 설명의 한계점이다. 매우 가벼운 원소의 원자는 복사에 의해 에너지를 빠르게 잃을 것이다. 가장 좋지 않은 경우는 단 한 개의 전자를 가지는 수소이다. 수소의 단 한 개의 전자는 어떤 에너지도 받지 못하고 방출하게 될 것이다. 그래서 전자는 나선을 그리며 재빨리 핵으로 떨어질 것이다. 러더퍼드의 모형에 따르면 우주에는 수소가 없어야 한다. 그러나 실제로는 수소의 전자는 안정하다.
즉, 전자가 에너지를 잃으면서 나선을 그리며 핵으로 떨어지는 일이 발생 하지 않는다는 것이다. 또한 스펙트럼의 문제도 있다. 전자가 에너지를 방출하면 회전 속도가 점점 감소하고, 이때 전자의 회전운동 에너지가 연속적으로 감소하므로 원자들에 의해 방출되는 복사 에너지의 스펙트럼은 연속 스펙트럼 이어야 한다. 그러나 실제로 원자는 고유의 파장만(진동수)을 갖는 불연속적인 선스펙트럼이 방출된다.

러더퍼드 α 입자 산란 실험결과로 만들어진 러더퍼드 원자모형은 위와 같이 많은 문제점들이 있지만 현대적인 원자모형을 제시한 것 외에도 제시된 원자모형의 문제를 보어가 해결하면서 양자역학의 정립에 아주 중요한 열쇠를 제공했다는 점이 러더퍼드 원자모형의 의의라고 할 수 있다.
[일반물리학실험]러더퍼드(Rutherford) 산란 실험_Vol.1
[일반물리학실험]러더퍼드(Rutherford) 산란 실험_Vol.1
educhemup.blogspot.com
[일반물리학실험]러더퍼드(Rutherford) 산란 실험_Vol.2
[일반물리학실험]러더퍼드(Rutherford) 산란 실험_Vol.2
educhemup.blogspot.com


댓글