
1. 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이다. 유색의 높은 농도의 용액은 낮은 농도의 용액보다 더 많은 빛을 흡수하게 됨을 실험을 통해 확인할 수 있다.
2. 우선 알려진 농도의 용액 5가지를 준비를 할 것이고, 분광광도계를 통해서 흡광도와 농도 사이의 그래프를 구성하면 비어의 법칙을 따르는 비례관계의 그래프를 구성하게 되며 그래프를 통해 미지용액의 농도를 확인 할 수 있다.
농도
액체나 혼합기체와 같은 용액을 구성하는 성분의 양의 정도. 용액이 얼마나 진하고 묽은지를 수치적으로 나타내는 방법이다.
몰농도(㏖arity, M) : 용액의 1L당 들어있는 용질의 ㏖수. 용액의 부피는 온도에 따라 변하기 때문에 역시 몰농도 또한 온도에 따라 변한다.
퍼센트 농도(%) : 아무언급이 없으면 무게 퍼센트 농도지만 상황에 따라 부피퍼센트와 무게/부피 퍼센트 농도가 있다. 용액 100g 속에 녹아있는 용질의 그램(g) 수로써 %로 나타낸다.
몰랄농도 : 용매 1000g속에 녹아 있는 용질의 몰수, m으로 표시한다. 용액의 질량이 아닌 용매만의 질량을 고려하는 농도 계산법이며, 부피가 아닌 질량을 이용해 계산하는 값이기 때문에 온도나 압력에 의한 영향을 받지 않는다는 장점이 있다.
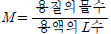
실험 방법
1. 실험 과정
1) 0.40M CuSO4·5H2O용액 30㎖을 비커(100㎖)에 넣습니다. 다른 비커에 증류수 30㎖를 넣습니다.

2) 5개의 15㎖ 튜브에 1-5까지 번호를 적습니다. (5번의 용액은 0,40M CuSO4·5H2O입니다.) 0,40M CuSO4·5H2O용액의 피펫 2, 4, 6, 8㎖을 튜브 1~4에 넣습니다. 또 다른 피펫을 사용하여 증류수 8, 6, 4, 2㎖을 시험관 1~4에 각각 넣습니다. 조심스럽게 젓개를 이용하여 각 용액을 잘 섞어줍니다. 각 튜브의 부피와 농도는 아래에 요약되어 있습니다.
3) 각 농도의 용액을 사각 cell의 표선까지 채운 후 흡광도를 측정한다. (분광광도계 사용법 숙지)
4) A(흡광도) VS C(농도)를 그래프에 도시한 후 기울기를 구하여 몰흡광계수(e)를 결정한다.
5) 미지시료의 흡광도를 측정하여 농도를 그래프로부터 읽는다.
[일반화학실험]용액의 농도 결정 레포트
1. 실험 목적 1.1. 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이다. 유색의 높은 농도의 용액은 낮은 농도의 용액보다 더 많은 빛을 흡수하게 됨을 실험을 통해 확인할 수 있다. 1.2. 우
www.happycampus.com


댓글