
학계, 연구 및 산업 계열에 종사하는 화학자들은 매일 새로운 화합물을 합성한다. 새로운 화합물을 특정하기 위해서 화학자들은 녹는 점, 색, 밀도, 원소 조성 등의 물리적 성질을 포함한 성질을 반드시 결정하여야 한다. 그 중 화합물의 몰 질량은 핵심적인 성질 중 하나이다. 화합물의 몰 질량을 측정하는 다수의 방법이 존재하는데, 이는 화합물의 성질에 따라 선택된다.
예를 들어, 단백질, 천연 약물 또는 효소 등의 생화학적 시스템에서 발견되는 큰 분자들의 몰 질량은 삼투압계를 이용하여 결정한다. 작은 분자들 중 용해성이 있는 분자들은 용액의 녹는점 변화를 이용하여 측정한다. 질량분석법의 최근 발전은 몰 질량 측정만이 아닌 생화학 분야에서 높은 몰 질량 화합물의 구조를 포함하도록 확장되었다.
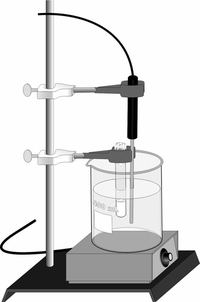
휘발성 액체는 낮은 끓는점과 비교적 낮은 몰 질량을 가지는 분자 물질으로, 뒤마 방법을 이용한 분석법을 통해 몰 질량을 측정했을 때 상당히 정확한 결과를 낸다. 이 분석 과정에서 액체는 측정된 온도와 기압을 가지고 고정 부피 용기에서 기화된다. 데이터와 이상 기체 상태방정식을 이용하면, 기화된 액체의 몰 수 는 다음과 같이 계산된다.

이 방정식에서 R은 보편 기체 상수를, P는 대기압을, V는 기화된 기체가 있는 용기의 부피(L)를, 는 증기의 캘빈 온도이다. 증기의 질량 mvapor는 빈 용기와 증기로 찬 용기의 차로 정해진다.

화합물의 몰 질량 Mcompound는 획득한 데이터를 바탕으로 다음과 같이 계산한다.

비교적 큰 분자간 힘과 큰 분자 부피를 가진 기체와 액체는 이상 기체 상태방정식에 따라 행동하지 않는다. 사실은, H2O등의 보통 고려되는 액체 등의 몇몇 물질들은 이상 기체와는 크게 벗어난 행동을 보인다. 이러한 조건에서, 변형 이상 기체 상태방정식인 van der Waals’ 방정식은 계에 존재하는 가스의 몰 수를 분자 간 힘과 기체 부피를 보정하여 적용해 계산할 수 있다.

이 방정식에서, P, V, T, R, n은 앞서 소개한 이상 기체 상태방정식과 같은 의미이며, a는 분자 간 힘을 의미하는 실험적 값이며 b는 분자의 부피를 의미하는 실험적 값이다.
[일반화학실험] Molar Mass of a Volatile Liquid 레포트
1. 실험 이론 및 원리 1.1. 실험 소개 학계, 연구 및 산업 계열에 종사하는 화학자들은 매일 새로운 화합물을 합성한다. 새로운 화합물을 특정하기 위해서 화학자들은 녹는 점, 색, 밀도, 원소 조성
www.happycampus.com


댓글