
FACS의 기본원리를 익히고 적용하는 방법을 알아본다.
유세포 분석기
유액상태의 입자나 세포가 일정 감지 지역을 통과할 때 각각의 입자나 세포를 신속하게 측정하여 세포의 크기, 세포 내부 조성정도, 세포기능 인지등 한 세포가 갖는 여러 특징을 동시에 측정하고 경우에 따라 특정 세포들만을 선택하여 분리할 수 있는 장비이다.
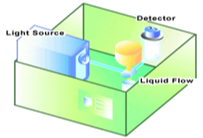
유세포 분석기는 측정하고자 하는 세포집단의 세포들을 각각 하나씩 측정하여 분석하는 특징을 가진다. 유액상태의 입자나 세포를 감지하기 위해서는 일정 파장을 띄는 형광이 표지된 항체 같은 형광염 색소의 표지가 필수적이며, 형광을 감지하는 방법으로는 광원인 레이저광원을 통한 형광의 발광작용을 이용한다.
세포는 형광항체법에 따라 표지하지만 여러 가지 형광표지제 개발로 현재는 단일여기파장에서 3종류 형광측정(즉, 3종류 다른 항원해석)을 일반적으로 시행할 수 있게 되었다.
복수 레이저사용으로 많은 매개변수 측정도 기능하게 되었다. 또, 세포에 Indol 등을 이입시켜 세포내 칼슘이온농도 변동을 위한 목적에도 사용할 수 있게 되었다. 또한 특정막 항원을 발현하고 있는 세포에만 전하를 부여하고, 후에 전장을 통과시키게 함으로서 목적인 세포집단만을 분산시킬 수 있게 되었다.
각각의 물리적 · 화학적 · 생물학적 성상을 계측하는 기술에 대해서는 산란광, 형광으로는 동일입자에 대해 다항목 동시측정, 예를 들면 세포의 형태, 크기, 다른 형광색소로 표지된 여러 종류의 단클론항체에 의한 분자발현을 해석할 수 있다. 배양세포, 림프계 장기나 혈류 중의 특정한 세포군, 플랑크톤을 비롯한 천연의 수중입자, 또한 특정 염색체의 분리 등에 널리 사용한다.
실험 방법
1. Permeabilization
1) 세포를 trypsin-EDTA를 이용해서 떼어낸 후 FACS 튜브에 1㎖ 옮겨 담는다.
2) 300G에서 centrifuge 해준 후 상층액을 제거한다.
3) 약하게 vortex하며 cold 70% ethanol을 넣어 cell fixation 한다.
2. PI staining
1) fixation했던 cell을 300G에서 centrifuge 하여 pellet 만들고 ethanol을 제거한다.
2) PBS를 이용하여 1번 wash 해준다.
3) centrifuge 해준 후 ethanol을 제거한다.
4) PI staining solution을 준비한다. PBS 375 ㎕ + PI 20 ㎕ + RNase A 5 ㎕
5) FACS tube에 준비된 PI 용액을 400 ㎕ 넣고 잘 풀어준 후 차광시켜 보관한다.
[분자생물학실험]Flow cytometry(FACS)를 이용한 cell cycle 분석 레포트
1. 실험 목적 가. FACS의 기본원리를 익히고 적용하는 방법을 알아본다. 2. 실험 이론 및 원리 가. Flow cytometry 1) 유세포 분석기 유액상태의 입자나 세포가 일정 감지 지역을 통과할 때 각각의 입자
www.happycampus.com


댓글