단백질을 SDS urea나 2-mercapto ethanol과 같은 환원제로 용해시킨 후, SDS로 (-)전하를 띄게 하여 size별로 분리 해 보자.
SDS-PAGE Gel 제조시 각 materials의 역할
Buffer의 선택은 gel의 resolution에 영향을 준다. Buffer는 반응을 하지 말아야 하고, 대부분의 protein과도 반응을 하거나 protein을 변화시켜도 안된다. 이때 Tris-HCl buffer는 이러한 성질을 가장 잘 갖추고 있는 buffer이다. 또한 Tris-HCl buffer는 pH값을 원하는 값으로 안정 시켜 준다.
그 다음으로 알아 볼 buffer는 acrylamide이다. 이 buffer는 물에서 vinyl addition polymerization이라는 반응을 일으킨다. Acrylamide는 물에 녹았을 때, 천천히 그리고 지속적으로 auto-polymerization이 일어나면서 긴 단일 가닥의 polymer를 형성하기 위해 분자들과 결합한다.
이때 free radical 발생 시스템이 있으면 polymerization은 더욱 더 잘 일어난다. 이러한 polymer chain의 용액은 chain들이 서로 미끄러지기 때문에 gel을 형성할 수 없다. Gel 형성은 다양한 chain이 함께 연결되어야 한다. 그래서 화학적으로 2개의 acrylamide 분자가 쌍을 이루고 있는 Bisacrylamide를 넣어서 gel을 형성하게 된다.
세 번째로 알아 볼 buffer는 SDS이다. SDS는 Sodium dodecyl sulfate의 약자로 화학식은 아래와 같다. 이 buffer는

매우 강한 세정제이다. 또한 protein을 구부러지지 않은 한 개의 polypeptides로 만드는데 쓰이기도 하는데 그 원리를 알아보자. 먼저 단백질 혼합체가 SDS가 있는 상태로 100℃로 가열됐을 때, 세정제는 polypeptide의 backbone을 감싸게 된다. 이때 polypeptides 내부의 charge는 SDS 자체의 negative charge에 비하여 무시할 만큼 작아진다. 이후 polypeptides는 일정한 전하 밀도를 가진 끈 구조가 된다.
또한 전기영동을 할 때 protein structure도 이동하는 속도에 영향을 준다. 그러므로 SDS가 전기 영동을 할 때 각각의 protein에게 polypeptides의 길이에 비례하는 일정한 negative charge를 준다. 이렇게 모양과 charge에 의해 차이를 없애주어 무게에 따라 protein이 분리 될 수 있게 해 준다.
그 다음은 APS이다. APS는 ammonium persulfate acrylamide의 약자로 매우 강한 산화제이다. APS의 화학식은 다음과 같다. 이 buffer
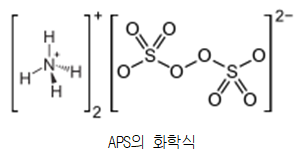
는 물에 매우 잘 녹으며 radical initiator로 자유롭게 가능 하다. 이때 radical initiator란 radical species를 안정한 상태로 만들 수 있고 radical reaction을 시작할 수 있는 물질을 말한다. 그러므로 acrylamide의 polymerization을 촉진하는 radical을 radical initiator로써 제공하여 gel 형성을 한다.
다섯 번째로 TEMED에 대하여 알아 보자. TEMED의 구조는 아래와 같다. 이때 이 buffer는 ammonium persulfate로부터 생기는

자유 반응기의 생성을 촉매하여 acrylamide와 bisacrylamide의polymer 형성을 촉진시킨다. 이때 TEMED는 다른 것과 결합하지 않은 자유로운 염 상태일 때에만 작용하므로 낮은 pH에서는 polymer 형성에 방해를 받게 된다. 마지막으로 알아볼 buffer는 glycine이다. Glycine의 구조는 아래와 같으며 위 실험에서 counterion으로 사용 되었다.

이때 SDS-PAGE gel에서 biffer ion의 내재적인 전하를 조절하는 역할하는 것을 counterion라 말한다. 또한 전기염동 도중에 전정기적 힘에 영향을 준다. 매우 높은 charge를 띄고 잘 움직이는 ion들은 SDS-PAGE에 적절치 못하다. 이때 glycine은 pKa가 9.69이고 움직임이 정해진 pH 범위에서 (-)charge에 가장 느리다고 알려진 protein보다 그 값이 낮기 때문에 매우 느린 ion이라고 할 수 있다. 그러므로 glycine은 SDS-PAGE에 매우 잘 맞는 ion이라 할 수 있다.
실험 방법
1. Gel making
1) Spacer plate와 short plate을 에탄올이나 DW로 먼지를 제거해 준다.
2) Spacer plate와 short plate를 꼭 맞게 겹친 후 short plate가 내 쪽으로 오게 casting frame에 고정시킨다.이때 두 plate의 밑면이 평평하게 잘 맞춰 졌는지 주의한다.
3) 가스켓이 plate를 충분히 밀착시켜주어 세지 않는지를 확인하기 위해 DW를 부어본다.
4) Plate가 떨어지지 않도록 손으로 잘 잡고 뒤집어 DW를 흘려보낸다.
5) Running gel과 stacking gel을 만든다. 이때 stacking gel은 10% APS와 TEMED를 빼고 만들어 둔다.
6) running gel을 plate에4㎖ 정도 부어준다. 이때 plate의 날개부분 까지 gel이 오도록 적당한 양을 부어준다.
7) running gel의 윗부분을 평평하게 해줄 isopropanol 200㎕를 넣는다.
8) 다 만든 running gel은 30min간 굳혀준다.
9) 그 30min 동안 sample을 만들어 준다.
10) Running gel이 다 굳으면 isopropanol을 따라 버리고 DW로 2~3회 wash해 준다.이때 plate가 빠질 수 있으니 손으로 잡고 주의해 가며 한다.
11) 미리 만들어둔 Stacking gel에 마지막으로 APS 50㎕와 TEMED 5㎕를 넣고 빠르게 plate에 붓는다.
12) 생긴 기포를 comb로 밀어서 제거한 후 plate 위쪽에 comb를 꽂는다.
13) 30min간 굳혀준다.
14) 다 마르면 comb를 빼고, 랩에 티슈를 놓고 DW로 충분히 적셔서 준비한다.
15) 그 위에 완성된 plate를 올리고 공기가 들어가지 않도록 유의하면서 티슈로 싸 준 뒤 마지막으로 랩으로 싼다.
2. Gel loading
1) Loading tank에 plate를 조립한다.
2) Running buffer를 두 plate사이에는 가득 채우고 이때는 plate를 두 set 사용 했기 때문에 바깥 면에는 2개 눈금 표시가 있는 곳까지 부어준다. 이때 Running buffer는 4℃에서 보관했으므로 vortexing을 충분히 해준 뒤 사용 한다.
3) Marker를 먼저 가장 왼쪽에 10㎕ 넣어준 뒤 PM, FT, 30-1, 30-2, 100-1, 100-2, 150-1, 150-2, 200-1, 200-2의 순서로 같은 양을 넣어준다.
4) 90V에서 30min간 loading한다.
5) running gel까지 band가 내려가면 120~130V로 1hr 30min간 loading한다. 이때는 gel의 거의 끝부분에 푸른 band가 걸릴 때까지 loading 해 준다.
[생명과학실험]SDS PAGE gel 제조 & Gel Loading & Coomassie Brilliant Blue Staining 레포트
Buffer의 선택은 gel의 resolution에 영향을 준다. Buffer는 반응을 하지 말아야 하고, 대부분의 protein과도 반응을 하거나 protein을 변화시켜도 안된다. 이때 Tris-HCl buffer는 이러한 성질을 가장 잘 갖추고 있는 buffer이다. 또한 Tris-HCl buffer는 pH값을 원하는 값으로 안정 시켜 준다. 그 다음으로 알아 볼 buffer는 acrylamide이다. 이 buffer는 물에서 vinyl additi
www.happycampus.com


댓글