
1. 일반화학에서 배웠던 눈으로는 볼 수 없는 세계, 즉, 미시적인 분자의 모양과 결정구조를 눈으로 볼 수 있도록 스티로폼 구와 막대를 이용하여 분자의 모양과 결정 모형을 만듦으로써 미시적 세계를 관찰해본다.
2. 분자이 모형을 통해 물질의 결합방식과 그 원인에 대해 알아본다 결정구조를 나타내는 모형을 통해서 고체의 구조를 이해한다.
분자 모형 특징
1. 물분자
물은 산소원자 1개와 수소원자 2개가 104.5도로 결합하여 생성된다 생물은 물이 없으면 살지 못하며 지구 근처의 행성중에서 물이 있는 별은 지구뿐이다.
2. 메탄분자
메탄은 유기물이 썩을 때 발생한다. 방귀로도 나오고 아마존밀림에서도 발생하며 음식썩은 것에서도 나오고 있다. 가정에서 연료로 사용하고 잇는 lng gas의 주성분인 메탄은 불에 잘 타지만 냄새는 없다 내내새 나는 것은 가스가 새는 것을 쉽게 알 수 있도록 섞은 다른 가스 때문이다.
3. 메탄올분자
가장 간단한 알코올은 메탄올이다. 실험실의 알코올램프의 원료로 사용된다 .30ml를 마시면 눈이 보이지 않게되고 그 이상을 마시면 사망에 이룰수 있는 독성이 있는 액체다.
4. 에탄올분자
보통 알코올이라 부르는 술에 들어있는 에탄올은 말한다. 마셔도 죽지는 않고 단지 취할 뿐이다. 많이 마시면 역시 독이 된다.
5. 벤젠분자
벤젠은 방향족 탄화수소롤 무색이고 가연성이며 발암물질로도 알려져있다. 탄소원자 6개와 수소원자6개가 결합한 형태로 탄소6개가 고리 모양의 화학결합을 하고 있다.
실험 방법
실험 1. 분자모형 만들기
1. 공 - 막대 모형
결합 길이에 비례하는 막대기를 사용하여 원자핵을 나타내는 공을 연결해 분자의 구조를 나타낸다. (거리는 과장됨*) 3차원 물체인 분자를 표현하는데 원자의 크기나 결합각 등을 표현하는데 적절하다.
2. 공간 - 채움 모형
원자의 전자 구름을 공으로 표현할 수 있는 분자모형이다. 분자 내 원자들의 상대적인 위치 뿐만 아니라, 상대적인 크기를 나타낼 수 있다. 하지만 결합을 명확히 표시할 수가 없다.
3. 전자 - 밀도 모형
단위 부피당 전자수에 따라서 공의 색을 다르게 표현한다. 모형은 공-막대 모형에 공간-채움 모형을 결합시킨 것이라고 생각하면 쉽다. 공간-채움 모형의 단점을 보완한 것이다. 즉, 분자의 모양에 따라 물리적.화학적 특성이 다르므로 모양을 이해하는 것이 중요하다.
실험 2. 결정의 구조
1. 육방 조밀 쌓음 구조
구조를 세 개의 층으로 나누어서 보면 구조가 abab가 반복되는 구조를 말한다. 아래의 그림을 참고해 보면 하나의 입자를 기준으로 위와 아래층에 3개, 같은 층에 6개로 총 배위수가 12개임을 알 수 있다.
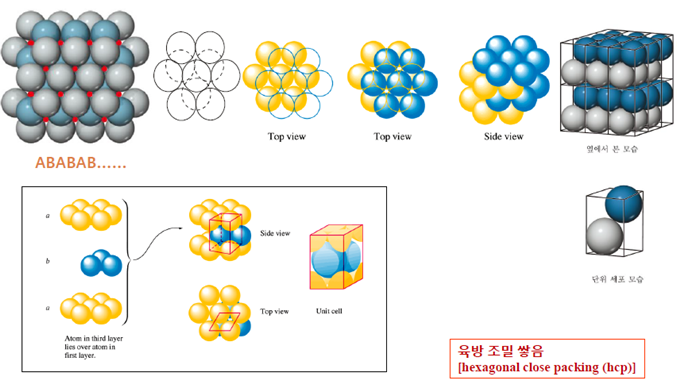
2. 입방 조밀 쌓음 구조
구조를 세 개의 층으로 나누어서 보면 아래의 그림처럼 구조가 abcabc로 순환하는 구조를 말한다. 하나의 입자를 기준으로 인접한 입자수 (즉, 배위수)가 12개이다.
3. 체심 입방 구조
육면체의 꼭짓점과 가운데에 입자가 존재하는 공간구조로 육방조밀 쌓음 구조나 입방 조밀 쌓음 구조와는 다르게 단위세포를 차지하는 정도가 낮다. (68%, 위의 두 가지는 74%), 배위수는 8개이다.
[일반화학실험]분자의 모양과 결정 구조 레포트
1. 실험 목적 가. 일반화학에서 배웠던 눈으로는 볼 수 없는 세계, 즉, 미시적인 분자의 모양과 결정구조를 눈으로 볼 수 있도록 스티로폼 구와 막대를 이용하여 분자의 모양과 결정 모형을 만듦
www.happycampus.com


댓글