
1. 고분자의 개요
2. 고분자 화학의 발전
3. 고분자(高分子, macromolecule)
4. 고분자 화합물
5. 고분자의 성질
6. 고분자 화합물의 종류와 용도
1. 고분자의 개요
고분자화합물의 합성은 오래 전인 19세기에까지 거슬러 올라가지만, 20세기 초반기까지의 셀룰로오스·고무 등의 천연 고분자에 대한 수많은 연구를 모체로 하여 1930년경 슈타우딩거에 의하여 처음으로 사슬모양 고분자의 개념이 명확히 제출된 이래, 고분자화학은 물리화학적 방법가지 받아들여 눈부신 발전을 하기에 이르렀다. 특히 40년 이후의 발전은 경이적이며, 현재도 이루 헤아릴 수 없는 새로운 고분자화합물들이 합성되고 있으며 새로운 합성방법이 연구되고, 또 이들의 특성이 연구되고 있다.
학문적으로는 현재 화학분야 중 가장 중요한 분야의 하나로 되어 있으며, 콜로이드화학·생화학·물리화학 등 이것이 관계되는 학문 분야도 넓다. 고분자화합물은 분자가 거대하기 때문에 기체로서 존재하지 않으며, 고체 또는 액체로만 존재한다. 기계적 강도가 크며 또 가열하면 고무모양 탄성체가 되기도 하고, 어떤 용매에 녹으면 팽윤하든지 점착성을 띠는 용액이나 콜로이드 용액이 되기도 한다. 이상과 같이 저분자화합물에서는 볼 수 없는 특이한 거동을 나타내는 특징을 가지고 있기 때문에 이 학문은 광범한 영역에 이르며, 대상 분야나 방법 등에 따라 고분자화학과 고분자물리학으로 나누어진다.
2. 고분자 화학의 발전
셀룰로오스, 단백질, 전분, 고무 등은 물 또는 그 외 용제에 용해되기 어려우며, 용액으로 된 경우에도 점도가 크며, 반투막을 통과하지 않는다. 또한 온도를 상승하여도 기체로 되지 않는다. 20세기 초에는 이들 물질이 대단히 많은 원자로 연결된 분자량이 큰 화합물이 아닌가 하는 의문은 가지게 되었으나, 오늘날과 같이 고분자라고 하는 개념은 확립되지 못한 시기였다. 1926년 독일의 H. Staudinger의 연구에 의해 이들 물질이 고분자라는 사실이 확인되었다. 그리하여 면, 마, 견, 양모 등도 고분자라는 것이 판명되었으며, 그 사이에 비스코스 레이온, 동암모니아인견 등도 제품화 되었다. 일본은 1915년 비스코스 레이온을 생산하였다.
가늘고 긴 천연섬유는 원자가 많이 연결된 가늘고 긴 고분자가 연신된 상태로 응집한 것이라는 것을 알게 되었다. 그래서 새로운 고분자를 합성하기 위한 연구가 활발하였으며, W.H. Carothers(미국, Du pont)는 거미줄 보다고 가늘고, 철보다 강한 섬유라고 평가 받는 나일론을 개발하였다. 누에는 점액을 토사한 실로서 고치를 만들며, 화학섬유도 이와 유사한 방법으로 실을 만들며, 견과 같은 실을 개발하기 위한 노력은 계속되어 점점 더 새로운 합성섬유를 탄생시키고 있다. 석유화학공업의 발전과 섬유의 연구로 인하여 새로운 합성고분자를 탄생시키고, 합성수지의 시대를 맞이하게 되었다.
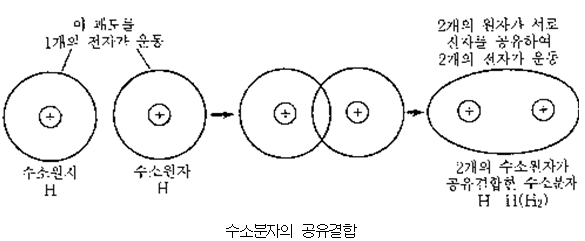
3. 고분자(高分子, macromolecule)
분자량이 1만 이상인 큰 분자를 말한다. 100개 이상의 원자로 구성되어 있다. 대개 중합체이다. 일반적으로 공유결합으로 원자가 결합하고 있는 분자는 그 자신은 안정하나, 분자간 응집력은 그렇게 강하지 않으며, 작은 분자는 자유롭게 운동하면서 서로 충돌을 반복하며 공중을 떠다니게 되는데 이것이 곧 기체이다. 분자가 크면 무겁게 되어, 공중을 떠다닐 수는 없지만, 힘을 가하면 자유로이 변형한다. 이것이 액체이다. 더욱 크게 되면 분자의 열 온도는 적어지게 되고, 분자는 강하게 결합된다.
이것이 고체이다. 예를 들면 천연가스, 그 중에서도 유전가스는 아래 그림에 나타낸 바와 같이 탄소수가 적은 메탄, 에탄, 프로판(비점 45℃)과 같은 파라핀계 탄화수소의 혼합체로서, 주성분은 메탄이다. 또한 가정용 연료로 사용되고 있는 액화프로판가스는 메탄에 비하여 탄소수가 많고 무겁기 때문에 압축(37.8℃에서는 13.4㎏ · CM-2 의 압력이 필요)하면 비교적 용이하게 액화한다.
그렇기 때문에 가스가 유출될 경우 바닥에 괴기 쉽고, 실외로 배출이 잘 되지 않기 때문에 폭발사고가 일어나기 쉽다. 더욱이 부탄(비점 0.6℃)은 적은 압력(37,8℃에서 3.8㎏ ·CM-2 )에서 액화하기 때문에 라이터 연료, 스프레이용 조제(현재는 거의 사용되지 않음)로 사용할 수 있다. 탄소수가 5이상이 되면 상온, 상압에서 액체로 되며, 이들 혼합물이 휘발유(가솔린에 가까운 것)로서 특히 탄소수가 증가하면 정유(煻油)에 가까운 것이 된다.
탄소수가 19이상이 되면 상온에서 고체가 되며, 파라핀 또는 납이라고 하며, 이 정도의 탄 소수는 그렇게 딱딱한 편이 아니며, 그다지 높지 않은 온도에서도 액상이 된다. 탄소가 수백에서 수천이상 결합하여 분자량이 1만 이상이 되면 상온에서는 대단히 견고하고, 융점도 100℃이상으로 된다. 이것이 폴리에틸렌이라고 하는 고분자 화합물이다. 다시 말하면 원자가 공유결합으로 다수 결합한 분자가 고분자이며, 이 집합체를 고분자화합물이라고 한다. 그림에서와 같이 원자는 측쇄에 지그자그로 연결되어 있기 때문에 고분자쇄라고도 한다.

[고분자화학]고분자의 이해 레포트
1. 고분자의 개요 고분자화합물의 합성은 오래 전인 19세기에까지 거슬러 올라가지만, 20세기 초반기까지의 셀룰로오스·고무 등의 천연 고분자에 대한 수많은 연구를 모체로 하여 1930년경 슈타우딩거에 의하여 처음으로 사슬모양 고분자의 개념이 명확히 제출된 이래, 고분자화학은 물리화학적 방법가지 받아들여 눈부신 발전을 하기에 이르렀다. 특히 40년 이후의 발전은 경이적이며, 현재도 이루 헤아릴 수 없는 새로운 고분자화합물들이 합성되고 있으며 새로운 합성방법
www.happycampus.com


댓글