
Protein Purification을 이해하고 SDS-PAGE 를 이용하여 Protein 을 정제해본다
전기영동
전기영동(electrophoresis)은 이온교환크로마토그래피와 마찬가지로 단백질분자의 전하를 이용한 분리, 분석법이다. 단백질 분자는 보통 등전점 이외의 pH에서는 양 또는 음의 전하를 가지고 있어서 일정한 pH의 완충액 중에서 직류전류를 가하면 양극 또는 음극방향으로 이동한다. 즉 단백질 분자의 전하량, 분자의 크기에 따라 전장 중에서 이동하는 속도가 다른 점을 이용하여 분리, 분석하는 것이다. 단백질을 여과지, 전분이나 agarose와 같은 다당류 gel, polyacrylamide gel 등과 같은 것을 담체로 하여 전기영동하면 단백질은 band를 형성하여 분리되므로 분리, 분석조작이 간단하게 된다.
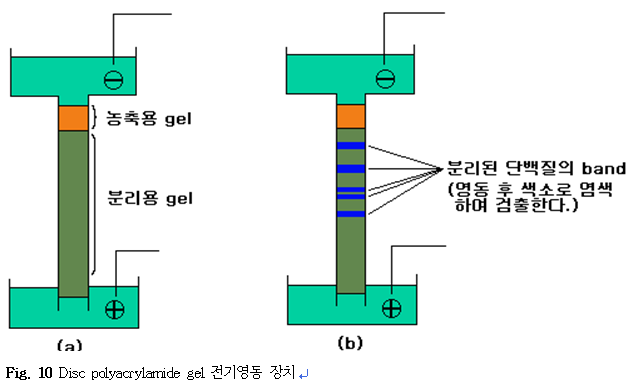
단백질 분석, 순도 검정, 분리정제에 일반적으로 이용되는 방법은 polyacrylamide gel을 disc 또는 slab으로 만들어 전기영동하는 것이다. 이 방법은 Fig. 10-(a)에 나타낸 것처럼 가교도와 농도가 다른 2가지의 polyacrylamide gel을 담체로 하고 시료단백질은 상층의 농축 gel 층에 가한다. 전류를 통하면 시료단백질은 농축 gel 중에서 얇은 층으로 되어 분리용 gel로 들어가 분리되는 구조로 되어 있다. 그러므로 분리된 각 단백질은 Fig. 10-(b)에 나타낸 것처럼 원반 모양의 얇은 층을 이루는 band로 되며 amidoblack이나 coomassie blue 등의 색소로 염색하면 선명하게 검출할 수 있다.
Acrylamide를 가교제(cross-linker)로 중합한 polyacrylamide gel 은 Acrylamide 와 cross-linker 의 농도 및 비율에 의해 gel 내에 미세통로의 크기를 조절할 수 있어 다양한 크기의 생체분자들을 분리할 수 있을 뿐만 아니라, 높은 정밀도와 고분해능으로 인해 오래 전부터 단백질, 핵산 등의 분리에 널리 사용되어 왔다.
실험 방법
1. Cell Mini-culture protocol
① 5㎖의 Autoclaved LB medium 에 Ampicilin을 100μg/㎖ 되게 test tube 에 넣는다.
② LB plate (Amp) colony 하나를 따서 test tube 에 넣고 37℃, 150rpm 의 incubator에서 pvernight culture 한다.
2. Cell Large-culture protocol
① 1L의 Autoclaved LB medium에 Ampicilin 을 100μg/㎖ 되게 가한다.
② Minicultured E.coli를 10㎖ 정도 seeding 한다.
③ 37℃, 150rpm 의 incubator 에서 3~4시간 culture 한다.
④ OD(Optical density)를 측정한다.(600nm에서 0.8~1.0범위의 absorbance를 관찰한다.)
⑤ IPTG 를 0.4mM (95.3 mg)되게 가한다.
⑥ 37℃, 150rpm 의 incubator 에서 3~4시간 culture 한다.
⑦ Harvest the culture by centrifugation 52000rpm, 4℃ 15mins.
⑧ storage at –70℃.
3. Lysis Protocol
① Harvest 된 cell 을 4㎖의 Lysis buffer에 suspending 시킨다.
② Lysis with sonicator (15mins, 4℃, 39~40watts, 0.8 Amp)
③ Centrifugation at 39000rpm for 15mins at 4℃.
④ Removed the insoluble fraction and save the supernatant for purification.
4. Purification of protein
① Supernatant 를 equilibrium GST․Bind Resin에 binding 시킨다. (At 4℃ for 30mins.)
② Washing with lysis buffer.
③ Elution with GST․Bind/Wash buffer.
④ Assay work.
5. SDS-PAGE
① 전기영동 키트의 고유한 방법에 따라 유리판을 casting 한다.
② Stacking gel 과 Running gel 용액을 준비한다. (Gel preparation)
③ Separation gel 용액에 ammonium persulfate 와 TEMED 를 첨가한 후 거품이 나지 않을 정도로 신속히 섞고 pipette을 사용하여 조심스럽게 유리판 사이의 공간에 붓는다.
④ Stacking gel의 높이를 고려하여 Separation gel 용액을 부어준 후 그 위에 증류수 또는 alcohol (ethanol, butanol, isopropanol 등 어떤 것도 좋으며 ethanol 이 가장 보편적이다.)을 조심스럽게 가해준다. (이는 running gel 의 윗 표면을 고르게 해주는 효과 외에 공기를 차단하여 gel 이 고르게 중합되게 하기 위한 것이다.)
⑤ Gel이 굳을 때까지 방치한다.
⑥ Gel이 굳으면 상층에 가한 ethanol 과 acrylamide 사이에 뚜렷한 경계가 보이는데 이때 ethanol 을 제거하고 증류수로 수차례 씻어준다.
⑦ 미리 준비해 놓은 Stacking gel 용액에 ammonium persulfate 와 TEMED 를 첨가한후 신속히 섞고 pipette 을 사용하여 조심스럽게 유리판 사이의 공간에 붓고 comb 을 끼운다.
⑧ Gel이 다 굳으면 조심스럽게 comb을 빼낸 후 형성된 well 을 증류수로 여러 차례 세척한다.
⑨ Casting 한 gel 을 전기영동장치에 장착하고 전기영동용 완충용액을 위와 아래의 완충용액 탱크에 붓는다.
⑩ Well에 조심스럽게 시료를 가한다.
⑪ 전기영동 기구를 전원에 연결 시킨 후 정전압 또는 정전류에서 전기영동을 한다.
⑫ 이동 지표인 bromophenol blue가 gel 의 끝부분에 도달하면 전원을 내리고 전기영동장치로부터 gel 판을 분리한다.
⑬ Gel을 조심스럽게 gel 판으로부터 분리한 후 플라스틱 또는 유리용기에 옮기고 staning solution을 붓는다.
⑭ Shaker 에 올려놓은 후 30분~1시간 염색한다. (전반적으로 gel 이 파랗게 보이고 단백질 밴드가 좀더 진하게 보이는 상태가 가장 좋다.)
[생화학실험]Protein Purification & SDS-PAGE 레포트
■ 실험목적 • Protein Purification을 이해하고 SDS-PAGE 를 이용하여 Protein 을 정제해본다 ■ 실험이론 및 원리 Cell은 수천종의 protein을 함유하고 있다. Protein은 전하, 크기, 용해도 같은 성질을 이용해 분리하며 이러한 성질은 각 protein마다 다양하다. 많은 단백질은 다른 생체분자와 결합하고 있기 때문에 단백질은 그들의 결합성질에 기초하여 분리할 수 있다. ∙ 단백질 분리 정제 ∘ 전하, 크기, 용해도
www.happycampus.com


댓글