1. Find the amount of OH- in a saturated Ca(OH)2 solution to calculate Ksp of Ca(OH)2
2. Ca(OH)2 로 포화된 용액에 OH- 이온을 넣어주면 공통이온 효과에 따라 Ca2+ 의 농도가 감소
3. 공통 이온 효과를 이용하여 Ca(OH)2의 용해도 및 용해도 곱 상수를 결정하는 방법을 알아본다.
Solubility
1. 일정한 온도에서 용매 100g에 녹을 수 있는 용질의 최대량
2. 용질의 그램수(g)
과포화용액 : 용해의 속도 < 석출의 속도
포 화 용 액 : 용해의 속도 = 석출의 속도
불포화용액 : 용해의 속도 > 석출의 속도
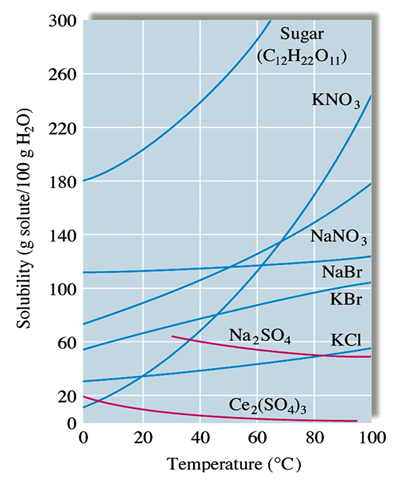
① 그래프의 기울기가 급할수록 온도에 따른 용해도 변화가 크다.
② 용해도 곡선 상에 있는 용액은 포화 상태이고, 곡선 아래에 있는 용액은 불포화 상태이다.
③ 어떤 용액을 냉각시킬 때, 석출되는 결정의 질량을 알 수 있다.
Common ion effect
1. 한 전해질 용액에 공통이온을 가진 다른 전해질을 첨가할 때 이온화가 감소한다
2. 공통이온효과는 르샤틀리에의 원리가 적용되는 예로, 평형계가 나타내는 현상이다
예를 들면, 만일 Ca(OH)2로 포화된 용액에 OH를 가하면 용해도곱을 일정하게 유지하기 위해 Ca2+의 농도가 감소하여 Ca(OH)2가 침전되는데, 이러한 현상을 ‘공통이온효과’라고 한다.
물 및 이미 그 농도를 알고 있는 NaOH 수용액에 고체 수산화칼슘을 넣어 포화시킨 다음 여기에 함유된 OH-의 농도를 염산 표준 용액으로 적정하면, 이 농도와 초기 농도의 차이가 Ca(OH)2로의 용해에 의한 OH-농도이다.
이것으로부터 Ca2+의 용해도 및 Ca(OH)2의 Ksp를 구할 수 있다.
실험 방법
Part I - Preparation of saturated Ca(OH)2
① 깨끗이 씻어서 말린 4개의 250㎖비이커(A,B,C,D)에 메스실린더를 이용하여 각각 증류수, 0.10M, 0.05M 및 0.025M의 NaOH 용액을 100㎖를 담는다.
② 각 비이커(A,B,C,D)에 약숟가락으로 한 숟가락 정도의 수산화칼슘 (Ca(OH)2) 고체를 넣는다.
③ 각 비이커(A,B,C,D)의 내용물을 유리막대를 이용하여 10분간 잘 저어 평형에 도달하도록 한다.
④ 각 용액을 Buchner 깔때기를 사용하여 감압하여 거르고 거른 용액 25 ㎖ 씩을 각플라스크(E,F,G,H)에 따로 보관한다.
⑤ 각 용액의 온도를 기록한다.
Part II - Titrate OH- saturated with HCl
⑥ 각 거른 용액 25㎖이 담긴 100㎖ 삼각플라스크에(E,F,G,H) 페놀프탈레인 2-3방울 가한 다음 0.10M HCl 표준용액으로 적정한다.

[일반화학실험]용해도 곱 상수의 결정 레포트
Purpose Find the amount of OH- in a saturated Ca(OH)2 solution to calculate Ksp of Ca(OH)2 공통 이온 효과를 이용하여 Ca(OH)2의 용해도 및 용해도 곱 상수를 결정하는 방법을 알아본다. Solubility 일정한 온도에서 용매 100g에 녹을 수 있는 용질의 최대량 용질의 그램수(g) 과포화용액 : 용해의 속도 < 석출의 속도 포 화 용 액 : 용해의 속도 = 석출의 속도 불포화용
www.happycampus.com


댓글