
1. 서로 섞이지 않는 두 용매 사이에서 용질의 평형 분배 고찰
2. 화학 평형상수의 의미를 이해한다.
3. 용액 중에서 일어나는 화학반응의 평형상수를 적정법으로 알아본다.
Dynamic Equilibrium State
1. 화학 평형
① 반응의(겉보기)종결
② 반응물과 생성물 농도(분압) 변화없음
③ 거시적 변화, 움직임 없음
④ 미시적반응 있음(동적 평형)
⑤ 반응진행방향에 무관함/반응물 생성물의 초기농도에 무관함
⑥ 화학적으로 가장 안정한 상태(자유에너지 최저) ⇒ △G=0
⑦ △H, △S 와 관련되며 T에 크게 의존함
⑧ 자발적 과정(반응진행)을 거쳐 평형(가역)도달
⑨ 반응속도와 무관(∴촉매와 무관)
⑩ 평형상수는 반응물과 생성물의 평형에서의 양적관계 표현(반응 진행 정도)
⑪ 평형상수는 온도만의 함수 다른 것과 무관
⑫ steady state(정적인상태) ≠ equilibrium (동적인상태)
Distribution Coefficient
1. 온도가 일정할 때 묽은 용액에서 한 물질이 한 물질 용매에서의 농도(CA)와 다른 용매에서의 농도(CB )의 비가 일정하게 되도록 서로 섞이지 않는 두 용매에서 분배된다.
2. 어떤 용매 S와 용질 S의 농도를 각각 [S]A, [S]B 이라 하면, 분배계수 Kd에.관한 식을 나타낼 수 있다.
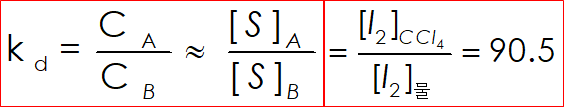
3. 분배계수가 성립되는 조건
① 두 액체상이 전혀 섞이지 않을 때
② 용질이 어느 상에서나 회합 또는 해리가 일어나지 않을 때
③ 용질의 농도가 비교적 낮을 때
④ 용질이 어느 상에서나 다만 소량 녹을 때
실험 방법
Part I - Chemical Equilibrium in solution
1. 0.025M KI3 30㎖ + 사염화탄소(CCl4) 15㎖ ⇒ 삼각플라스크
2. 플라스크 흔들어 준 뒤 눈금실린더에 붓기
Part II - Titration
3. 적정 할 용액을 피펫으로 빼낸다.
4. 0.01M Na2S2O3 으로 적정 (청자색이 없어질 때가 종말점)하여 부피를 기록하고, 평형상수 값을 구한다.
[일반화학실험]화학평형상수의 결정 레포트
평형 분배 상수(equilibrium distribution constant) 용매 추출(solvent extraction)의 기본원리 액액평형(liquid/liquid equilibrium) 상(phase) 2 용매(solvent) 2 상(phase) 1 용매(solvent) 1 용질(solute) A General Chemistry Experiment Reversible Rxn * 화학 반응에서 어느 정도의 시간이 지나면 반응물질과 생성물질의 농도가
www.happycampus.com


댓글