
1. EDTA를 이용한 적정원리와 응용을 이해하고 천연수 조성을 분석한다.
2. 지하수에 들어있는 금속 이온을 EDTA에 반응시켜 전체 금속 이온 농도를 구하여 와 을 분석한다.
3. 금속이온과 킬레이트 시약의 반응에 의해 킬레이트 화합물이 생성되는 반응을 이용하여 EDTA와 반응할 수 있는 전체 금속이온의 농도를 구할 수 있다.
킬레이트(Chelate)
착이온(complex ion)은 이온이나 중성분자들에 의하여 둘러싸인 중심이온(금속이온)으로 이루어진 이온이다. 한 개의 리간드가 금속 이온과 두 자리 이상에서 배위결합을 하여 생긴 착이온을 뜻한다. Cu(OH)42+등이 그 예이며 각 경우에 Cu2+가 중심이온이 된다.
예를 들어 구리가 포함된 용액에 에틸렌다이아민의 수용액을 가할 때 구리는 에틸렌다이아민의 두개의 아민기의 질소 원자와 결합하여 고리모양의 착이온을 만드는데, 이렇게 해서 생성된 화합물을 킬레이트라 한다. 킬레이트를 형성하는 대표적인 리간드로는 에틸렌다이아민, EDTA가 있다. EDTA의 경우에는 2개의 N이 비공유 전자쌍을 갖고 있으므로 ligand 역할을 잘한다.
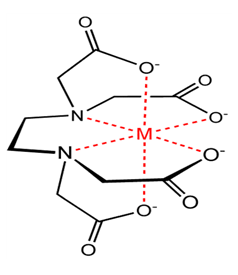
킬레이트화(chelation)는 한 개 이상의 결합을 하는 중성분자나 이온을 포함하는 “착이온”을 형성하는 것을 일컫는다. 킬레이트(chelate)란 말은 그리스어의 chele 즉 “claw(집게발)”로 부터 유래된다. 킬레이트제(chelating agent)는 둘 또는 그 이상의 중심이온에 붙을 수 있는 “집게발” 또는 결합자리를 가지고 있다.
본 실험에서는 킬레이트제로서 ethylendiamine tetraacetic acid의 disodium염을 사용하게 된다. (disodium은 두 개의 sodium을 뜻한다.) 이것을 간단히 EDTA라 부르며, 화학 방정식에서는 간단히 Na2H2V라 쓰게 된다. 이것은 용액 속에서 이온화할 수 있는 두 개의 나트륨 원자와 2개의 수소 원자가 분자내에 존재한다는 것을 강조해 주는 표기 방법이다. 또한 V는 EDTA의 그 외의 잔여기를 나타내 준다. 나트륨 원자는 이온화하지만 수소 원자는 단지 염기 용액에서만 이온화한다. 이것은 용액 중에서 수소이온의 총 농도는 매우 낮다는 것을 의미하고 있다.
금속 이온 지시약(metal ion indicator)
1. EDTA 적정법에서 종말점의 검출을 위한 가장 일반적인 방법
2. 금속 이온 지시약은 이것이 금속 이온과 결합할 때 색이 변하는 화합물이다.
3. 지시약으로 사용되려면, 지시약은 EDTA보다 약하게 금속과 결합해야만 한다.
4. 자유 지시약의 색깔은 pH에 의존하므로 대부분의 지시약들은 일정한 pH영역에서만 사용가능
5. 지시약으로부터 금속이 자유롭게 유리되지 않는다면 금속이 지시약을 막았다(block)고 한다.
실험 방법
(1) Ca2+ 이온과 Mg2+이온의 총 농도 측정
① Na2H2EDTA·H2O (FW 372.25)를 80℃에서 1시간동안 말리고, 건조용기에서 식힌다. 약 0.6g을 정확히 달아 물 400㎖가 든 500㎖부피플라스클 데우면서 녹인다. 실온으로 식히고, 표선까지 묽혀서 잘 섞는다.
② 피펫으로 수돗물(시료용액) 50㎖를 세 개의 250㎖ 플라스크에 취한다. 바닷물 1.000㎖나 수돗물 50.00㎖를 가한다. 각 시료에 pH 10 완충용액 3㎖와 EBT 지시약 여섯 방울을 가한다. 50㎖ 뷰렛에 담은 EDTA로 적정하여 포도주빛 붉은색이 파란색으로 변하는 것을 관찰한다. 소량의 물을 첨가하고 좀더 많은 양의 EDTA로 적정함으로써 종말점 찾는 연습을 여러 번 할 필요가 있다. 종말점에 도달한 용액은 다른 적정에서 종말점 색깔을 비교하는 데 사용하기 위해 보관한다.
③ 적정을 세 번 반복하여 전체 Ca2+ + Mg2+ M 농도의 정확한 값을 얻도록 한다. 증류수 50㎖로써 바탕적정을 하여 각 결과에서 바탕값을 빼준다.
(2) Ca2+이온과 Mg2+이온 각각의 농도 측정
④ Ca2+ 정량을 위해, 시료 네 개를 깨끗한 플라스크에 취한다.(1.000㎖의 바닷물을 사용한 경우 증류수 50.00㎖를 가한다). 50wt% NaOH 30방울을 각 용액에 가하고, 2분간 흔들어서 Mg(OH)2를 침전 시킨다. (보이지 않을 수도 있다.) 고체 히드록시나프톨 파랑 지시약(Hydroxynaphthol blue) 약 0.1g을 각 플라스크에 가한다. (이 지시약은 EBT보다 더 높은 pH에서 파란색으로 남아 있다.) 한 시료를 재빠르게 적정하여 종말점을 구한다. 필요하면 여러번 연습한다.
⑤ 나머지 세 시료를 주의 깊게 적정한다. 파란색 종말점에 도달한 후, 가끔 저어주어 침전물을 전부 녹이면서 5분간 방치한다. 그 다음에 파란색 종말점까지 다시 적정한다. (세워둘때 파란색이 붉은색으로 바뀌면 이 과정을 반복한다.) 증슈루 50㎖로 바탕적정을 한다.
⑥ Ca2+와 Mg2+의 전체농도, 개별이온의 농도를 계산하라. 적정을 되풀이 했을 때의 상대표준편차를 계산하라.
[분석화학실험]EDTA titration of Ca2+ and Mg2+ in Natural Waters 레포트
1. 실험 목적 ∙ EDTA를 이용한 적정원리와 응용을 이해하고 천연수 조성을 분석한다. ∙ 지하수에 들어있는 금속 이온을 EDTA에 반응시켜 전체 금속 이온 농도를 구하여 와 을 분석한다. ∙ 금속이
www.happycampus.com


댓글