
음이온교환 크로마토그래피를 이용하여 우리가 얻고자 하는 β-galactosidase를 분리해낸 후 ONPG와 반응시켜 효소의 활성을 확인하고 SDS-PAGE를 이용하여 정제된 β-galactosidase의 밴드 존재유무와 위치를 알아보는 것이었다.
크로마토그래피(Chromatography)
크로마토그래피는 혼합물로부터 그 성분들을 순수하게 분리하거나 확인, 정량하는데 사용하는 편리한 방법 중의 하나이다. 이 방법에 의한 물질의 불리는 혼합물이 정지상(stationary Phase)이나 이동상(mobile phase)에 대한 친화성이 서로 다른 점을 이용하는 것으로, 이 친화성에 중요한 영향을 미치는 인자는 흡착, 이온화 및 분배계수들로써 여러 종류의 크로마토그래피는 이들 인자가 서로 합하여 작용하게 된다.
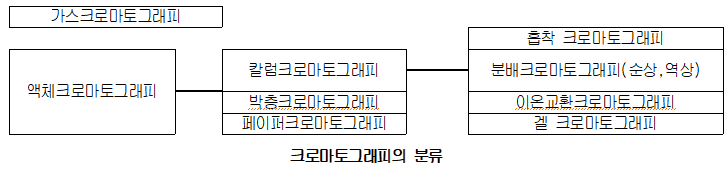
크로마토그래피의 분류 방법에는 여러 가지가 있지만, 일반적으로 이동상의 차이에 따른 분류를 대분류, 이동상과 고정상을 조합시킨 분류를 중분류, 이동상과 고정상을 조합시키고 분리의 상호 작용을 고려한 분류를 소분류라고 한다. 크로마토그래피는 이동상의 차이에 따라 두 가지 방법으로 크게 나눌 수 있다.
그 하나는 기체를 이동상으로 사용하는 가스 크로마토그래피(GC)이고, 다른 하나는 액체를 이동상으로 사용하는 액체 크로마토그래피(LC)이다. LC는 사용하는 고정상의 종류에 따라 칼럼 크로마토그래피(Column Cromatography), 박층 크로마토그래피(TLC), 페이퍼 크로마토그래피(Paper Partition Chromatography)등으로 나눌 수 있다.
중압액체 크로마토 그래피(FPLC)와 고속 액체 크로마토그래피(HPLC)는 시료의 신속 분석을 목적으로 특별한 장치를 이용한 칼럼 크로마토그래피의 일종이다. 두 크로마토그래피는 단시간에 분리가 가능한 방법이다. 그중 HPLC는 시료의 분리에 작용하는 상호 작용에 따라 흡착 크로마토그래피(Absorption chromatography), 분배 크로마토그래피(Partition chromatography), 이온교환 크로마토그래피(Ion exchange chromatography), 겔침투크로마토그래피(gel permeation chromatography)의 종류로 나눌 수 있다.
컬럼 크로마토그래피를 사용하는 것은 주로 대용량을 분리할 때이다. 다른 크로마토그래피들은 소량으로 구성성분을 분석하는 목적이 있지만 컬럼 크로마토그래피는 많은 양의 분리에 목적을 두고 있다. 100 ㎖ 정도도 사용할 수 있지만 그보다는 적은 양을 분리할 때 사용한다. 컬럼도 여러 종류가 있어 필요에 따라 사용할 수 있다. 컬럼에서 분리되어 나오는 것은 TLC의 역순이라고 보면 된다. 이유는 TLC는 극성이 강할수록 빠르게 멀리 이동하지만 컬럼에서는 더욱 늦게 나오게 된다. 따라서 비극성 물질이 먼저 나오고 나중에 극성 물질이 나오게된다.
β-galactosidase
β-갈락토오스해리효소(β-galactosidase or lactase)는 우유와 치즈에 함유되어 있는 유당(lactose)을 가수분해하여 포도당과 갈락토오스를 생산하는 효소의 총칭이다. 따라서 이 효소는 유당의 소화, 흡수가 어려운 사람에게 적합한 유제품을 제공하며 부가적으로 유당 함유제품의 감미도와 용해성을 증대시켜주는 특징이 있다. 그러나 β-갈락토오스해리효소의 가수분해 양상은 반응조건에 따라 매우 상이적이며, 특히 가수분해증에 갈락토오스를 전이하여 올리고갈락토오스류 혹은 갈락토오스다당(galatooligosccharide)을 생성하기도 한다.
실험 방법
1. 크로마토그래피(Chromatography)
1) E.coli (pUC19)배양
① E.coli를 LB 배지, 37℃에 1L를 배양한다.
② 7,000rpm, 4℃에서 원심분리하고, 상등액(배지)은 버리고, 침전물(E.coli)을 취한다.
③ E. coli cell을 다음 용매에 suspension 시켜준다. 1mM PMSF, 4mM Leupeptin, 4mM Pepstatin, 4mM beta-mercaptoethanol, 20mM Tris-HCl, 30mM , 10mM , 1mM EDTA, 10%glycerol
④ Sonicator(초음파 분쇄기)로 20min동안 E. coli cell을 lysis시킨다. 이때 열로 인하여 변성될 수 있으므로 얼음에 넣은 체로 용해시킨다.
2) DEAE-cellulose chromatography
① DEAE-cellulose resin packing
② A (0.2M Tris (pH 7.5)) buffer로 resin을 equilibrium(안정) 시켜준다.
③ B (0.2M Tris 3M NaCl (pH7.5)) buffer로 resin에 붙어 있는 sample을 용출 시킨다.
④ Fraction collector에 모은 시험관은 차례대로 숫자로 표기한다.
3) Enzyme assay
4) Beta-galactosidase가 분해할 수 있는 기질을 사용하여, enzyme 여부를 확인 할 수 있다.
2. β-galactosidase activity
1) 96 well microplate에 Z buffer 100㎕를 넣어 준다.
2) Orthonitrophenyl-β-D-galactropyranoside (ONPG)를 DW에 4㎎/㎖로 만든 용액50㎕를 96 well microplate에 넣어준다.
3) Ion-exchange (DEAE-cellulose) chromatography를 이용하여 β-galactosidase를 분리한 fraction(시험관)에서 각각 100㎕를 취해 96 well microplate에 넣어 준다.(※ 정제된 시험관은 4℃에서 보관한다.)
4) 37℃ incubator에 15분 동안 반응시켜준다.
5) 반응이 끝나면 1M sodium carbonate 50㎕를 넣어 반응을 멈춘다.
6) Microplate reader기를 이용하여 흡광도 420㎚에서 optical density값을 잰다.
7) 나온 결과를 바탕으로 그래프를 그려본다.
3. SDS-page
1) 유리판 사이에 comb를 미리 꼽아보고 comb의 밑 부분에서 약 1㎝ 밑으로 선을 표시한다.
2) 표를 참고하여 running gel과 stacking gel의 용액을 혼합한다.
3) Comb를 제거하고 running gel 용액에 15㎖의 30% ammonium persulfate와 3㎕의 TEMED를 첨가한 후 거품이 나지 않을 정도로 신속히 섞고 파이펫을 사용하여 조심럽게 유리판 사이의 공간에 붓는다.
4) Gel mi×ture의 높이가 미리 표시한 선까지 도달하면 iso-propanol을 500㎕정도 넣어준다. Gel이 굳을 때까지 30분간 방치한다.
5) Gel이 굳으면 상층에 가한 iso-propanol과 acrylamide 사이가 구분된다.
6) Stacking gel 용액을 만들고 거품이 나지 않게 신속히 섞고 파이펫을 이용하여 유리판 사이의 공간에 붓고 comb을 설치한다.
7) Stacking gel이 굳는 동안 sample buffer가 들어있는 시료를 100℃에서 3분간 가열하여 단백질을 변성시킨다.
8) Gel이 다 굳으면 조심스럽게 comb을 제거한다.
9) 굳힌 gel을 전기영동 기구에 장치하고 위와 아래 완충용액 통에 전기영동 완충 용액을 붓는다.
10) Gel 홈에 시료를 가한다.
11) 전기영동 기구를 전원에 연결시킨 후 전압을 걸어준다.
12) Bromophenol blue가 resolving gel에 도달하면 전압을 올리고 bromophenol blue가 resolving gel의 끝까지 갈 때까지 전기영동을 실시한다.
13) Gel의 3배 부피에 해당하는 염색액에 담근 후 염색이 충분히 될 때까지 서서히 흔들어 준다.
14) 염색액을 제거한 후 염색약이 포함되지 않은 destaining solution에 gel을 담가두어 탈색시킨다.
[생화학실험] β-Galactosidase purification & activity & SDS PAGE 레포트
1. 실험 목적 1.1. 음이온교환 크로마토그래피를 이용하여 우리가 얻고자 하는 β-galactosidase를 분리해낸 후 ONPG와 반응시켜 효소의 활성을 확인하고 SDS-PAGE를 이용하여 정제된 β-galactosidase의 밴드 존재유무와 위치를 알아보는 것이었다. 2. 실험 이론 및 원리 2.1. 크로마토그래피(Chromatography) 크로마토그래피는 혼합물로부터 그 성분들을 순수하게 분리하거나 확인, 정량하는데 사용하는 편리한 방법 중의 하...
www.happycampus.com


댓글