
전하가 이온에 의하여 운반되는 전해질 전도(electrolytic conduction)는 전해질의 이온이 자유로이 움직일 수 없으면 일어나지 않는다. 따라서 전해질 전도는 주로 용융된 염과 전해질의 수용액에서 나타난다. 더욱이 전해질 전도체를 통하여 전류가 계속 흐르기 위해서는 이온의 이동에 따르는 화학 변화가 필요하다.
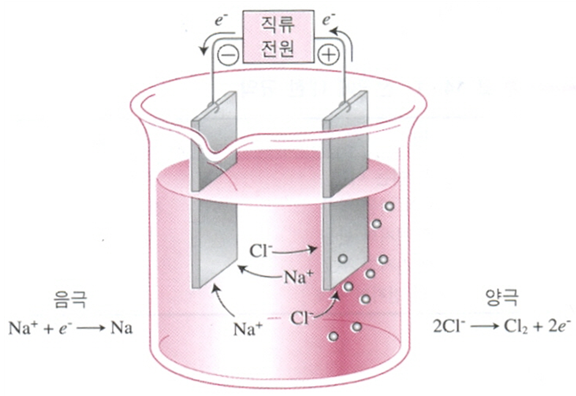
이 전해질 전도의 원리는 두 불활성 전극 사이에서 용융 NaCl의 전기분해를 나타내는 [그림 1]의 전해전지로 설명할 수 있다. 전원이 왼쪽 전극에 전자를 공급하여 주므로 이 전극은 -로 하전되었다고 간주하면 전자는 오른쪽 +극에서 빠져나간다. 이렇게 이루어진 전장에서 나트륨 이온(양이온)은 -극 쪽으로 끌리고 염소 이온(음이온)은 +극 쪽으로 끌린다.
전해질 전도에서 전하는 음극 쪽으로 이동하는 양이온과 양극을 향하여 반대 방향으로 이동하는 음이온에 의하여 운반된다. 완전한 회로를 이루기 위해서는 전극에서 이온의 이동이 수반되어야 한다. 음극에서는 어느 화학종이 전자를 받아 환원되어야 하고, 양극에서는 전자가 어느 화학종으로부터 제거되어 산화되어야 한다. 양극과 음극에 관계된 규약을 [표 1]에 요약했다.
|
명 칭 |
음 극 |
양 극 |
|
이끌리는 이온 |
양이온 |
음이온 |
|
전자의 이동방향 |
전지 내로 |
전지 밖으로 |
|
반쪽전지의 반응 |
환 원 |
산 화 |
|
전해전지의 부호 |
- |
+ |
|
갈바니전지의 부호 |
+ |
- |
표 1 전극에 대한 규약
[그림 1]에 표시된 전지에서 나트륨 이온은 음극에서 환원되고, 염소 이온은 양극에서 산화된다.

이 두 부분의 화학 방정식을 합하면 완전한 화학 방정식을 적을 수 있다.
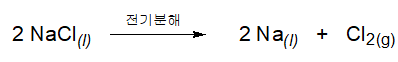
금속 나트륨을 생산하기 위하여 사용되는 상업용 전지의 실제 조작에서는 염화나트륨의 녹는점을 낮추기 위하여 염화칼슘을 가하고 약 600oC에서 전지를 작동시킨다. 이 온도에서 나트륨 금속은 액체이다. [그림 1]의 회로를 통하여 음 전하의 흐름을 다음과 같이 추적할 수 있다. 전자가 전원을 떠나 음극(cathode)으로 들어가면 이미 이 음극에 끌려온 나트륨 이온이 이 전자를 취하여 환원된다. 염소 이온은 음극을 떠나서 양극(anode)으로 향하여 이동하므로 양극쪽으로 음 전하를 운반한다. 양극에서는 전자가 염소 이온으로부터 제거되므로 이들은 산화되어 염소 가스가 된다. 이 전자들은 전원에 의하여 전지의 밖으로 펌프되어 나간다. 이런 방법으로 회로가 완성된다.
전해질 전도는 이온의 이동성에 기초를 두고 있으므로 이온의 움직임을 방해하는 어떤 것도 이 전류에 저항을 일으킨다. 전해질 용액의 전기 전도도에 영향을 주는 인자들은 이온 사이의 인력, 이온의 용매화, 용매의 점성 등이다. 이 인자들은 각각 용질-용질간의 인력, 용질-용매간의 인력 및 용매-용매간의 인력 때문에 생긴다. 용질 이온의 평균 운동 에너지는 온도가 상승함에 따라 증가한다. 더욱이 앞에 언급한 세 가지 인자들의 효과는 온도가 상승함에 따라 감소한다. 하지만 용액은 언제나 전기적으로 중성이다. 양이온의 +전하의 총수는 모든 음이온의 -전하의 총수와 같다.
[일반화학]전기화학 레포트
1. 전해질 전도 전하가 이온에 의하여 운반되는 전해질 전도(electrolytic conduction)는 전해질의 이온이 자유로이 움직일 수 없으면 일어나지 않는다. 따라서 전해질 전도는 주로 용융된 염과 전해질
www.happycampus.com


댓글