
1. C-C간의 결합을 형성하는 방법으로써 합성에 유용한 aldol reaction을 조사한다.
2. Ketone으로 확장되는 aldehyde의 일반적인 반응이다.
3. 아세톤과 벤즈알데히드로부터 다이벤잘아세톤(benzalacetophenone)의 합성
알돌 축합 반응 (Aldol reaction)
알데히드가 NaOH 수용액과 같은 염기로 처리할 때 생성되는 에놀 음이온은 탄소 친핵체로 작용할 수 있다. 에놀 음이온이 다른 알데히드나 케톤 분자의 카르보닐기에 들어가는 반응은 알돌 축합반응(Aldol Condensation)이라고 하며 이 반응은 탄소와 탄소의 결합을 형성하는 매우 유용한 반응이다. 알돌 축합반응의 가장 간단한 반응의 예는 아세트 알데히드 두 분자가 축합하는 것을 들 수 있다. 이 반응에서 염기가 촉매로 작용하므로 염기성 수용액을 용매로 사용한다.
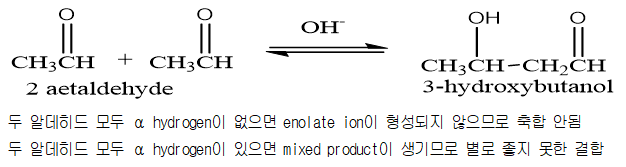
가장 단순한 형태로서 알돌 축합은 같은 알데히드 또는 케톤 두 분자가 축합을 이루는 것으로 한 분자의 카르보닐 탄소가 두 번째 분자의 α 위치에 연결됨으로써 새로운 C-C 결합을 형성하게 된다.
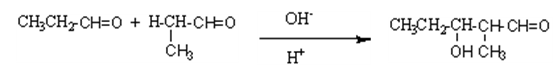
이 반응의 생성물을 알돌(aldol) 이라고 부른다. 알돌이란 단어는 알데히드와 알코올로부터 유래되었으며 B-히드록시 알데히드인 생성물을 나타낸다. 축합반응은 둘 혹은 그 이상의 분자가 작은 분자(물과 같은)가 떨어져 나가면서 더 큰 분자로 결합하는 반응이다. 그렇다면 알돌축합반응은 어떻게 일어나는가? 만일 아세트알데히드가 묽은 NaOH 수용액과 반응하여 저농도의 엔올산이온이 형성된다.
이 반응은 엔올산이온이 반응이 진행됨에 따라 더 생성되는 가역반응이다.즉, 염기(수산화이온)는 알데히드 한 분자의 α 탄소로부터 양성자를 떼어내어 공명―안정화된 엔올산이온을 만든다 그래서 알돌 축합반응은 3단계 반응 메커니즘으로 일어난다.
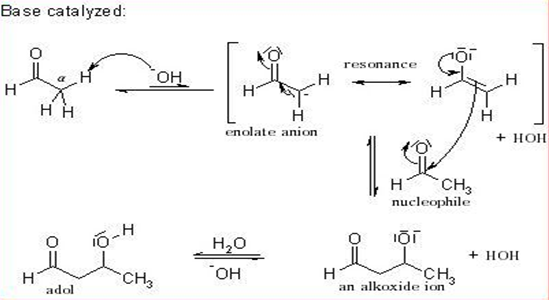
이 반응에서 항상 α-탄소만이 친핵체로 작용하므로, 알데히드와 탄소 사이에 항상 탄소 원자 1개가 들어 있는 화합물이 생성된다. 이것은 출발물질인 알데히드에 탄소 원자가 몇 개 있는가와 무관하다. 그래서 이러한 반응식을 위해 분자간 반응성이 큰 카르보닐기를 가지고 α 위치의 양성자를 잘 떼어내서 엔올 음이온을 형성할 수 있어야 한다.
Mechanism
아세톤과 벤즈알데하이드의 축합 생성물은 벤잘아세톤이다. 이 화합물은 염기 촉매 하에서 엔올레이트 이온을 생성한다. 알돌-형태축합의 일반적인 형태의 반응은 음으로 하전된 탄소원자를 가진 화학종을 포함한다. 이와 같은 이온을 흔히 카르보음이온이라고 부른다. 염기촉매의 작용에 의해서 카보음이온이 상당량 형성되기 위해서는 생성된 음으로 하전된 탄소원자가 알데하이드, 케톤 및 산유도체의 카보닐기, 사이아노기와 나이트로기와 같은 상당히 효과적인 전자끌기에 의해 치환되지 않으면 안된다. 알돌-형태의 축합인 더 일반적인 형태는 알데하이드와 케톤의 카보닐기 이외에 더 활성인 작용기에 카보음이온의 첨가를 수반한다.
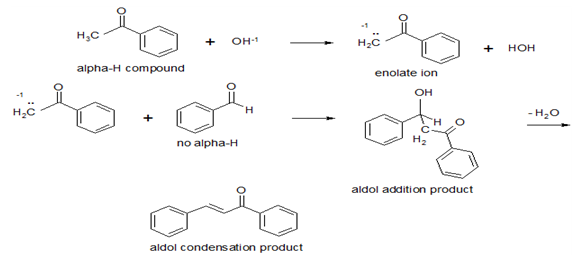
또한 반응의 개요는 알데하이드의 카보닐기에 아세톤의 활성 메텔렌 음이온의 친핵성 부가가 일어난 후 스스로 탈수되어 C6H5CH=CHCOCH3를 생성하는 반응이다. 이어 생성된 화합물의 음이온인 C6H5CH=CHCOCH2-이 재차 반응을 반복하여 최종적으로 다이벤질아세톤을 합성하는 반응이다. 활성 메틸렌기와 알데하이드를 포함하는 본 축합반응을 하기에 나타낸 반응 조건하에서는 중간생성물 단계에서 멈출 수 없다.
실험 방법
1. 실험 과정
1) Magnetic spin bar를 넣은 50㎖ flask에 acetopheone 601㎎(0.58㎖, 5.0m㏖), ethanol 1.5㎖ 10% NaOH 2.5㎖(6.3m㏖)을 가한 다음 benzaldehyde 526㎎(0.5㎖, 5.0m㏖)을 가한다.
2) 반응 혼합물을 2시간 동안 70~80℃에서 교반한다.
3) 반응 마무리 및 생성물의 분리
① 반응 혼합물 1:4 ehtyl acetate / hexane의 혼합 용매를 전개 용매로 하여 TLC 분석을 하여 출발 물질의 잔류 정도와 새로운 화합물의 생성을 확인한다.
② 생성물이 고체로 얻어질때 까지 반응 flask를 고체 얼음 bath에 30분 정도 놓아둔다. 고체 생성물을 진공하에서 여과하고 건조한 다음 무게를 측정하여 수율을 계산한다.
③ 순수한 chalcone의 mp는 55~57℃이다. 제조한 chalcone의 mp를 측정하여 비교한다. 1:4 Ethyl acetate / hexane 또는 1:4 acetone / hexane의 혼합 용매를 전개 용매로 하여 생성물을 출발물질들과 TLC를 분석하여 UV lamp로 확인한다.
④ 생성물을 적당한 방법으로 IR 분석하여 chalcone의 carbonyl기를 확인하여 문헌에 알려진 spectrum과 비교한다.
⑤ 생성물을 CDCl3 용매에서 H-NMR 분석하여 chalcone의 Vinyl hydrogen을 확인하고 문헌에 알려진 spectrum과 비교한다.
[유기화학실험]Aldol Condensation(알돌축합) 1부
[유기화학실험]Aldol Condensation(알돌축합) 1부
educhemup.blogspot.com
[유기화학실험]Aldol Condensation - Preparation of benzalacetophenone 레포트
Green Chemistry 반응과 과정이 화학적 위험요소를 가질 때 인간과 환경의 위험에 대한 노출을 최소화 할 수 있다. 그리고 환경과 관련된 위험을 줄이거나 제거시킬 방법을 찾을 수 있다. 전통적으로 전자가 더 강조되어 왔다. 발전된 기술과 시설이 위험에 대한 노출을 최소화 하는데 도움을 주어온 것 이다. 유기화학 연구들이 오래전부터 논해왔던 것과 반대로 현재의 실험 실습들은 화학물질을 다루는 것에 있어 보편적인 상식을 강조한다. 그 보편적인 방법은
www.happycampus.com


댓글