
Plaque assay
1952년 Renato Dulbecco는 plaque assay를 응용하여 bacterial virus stock의 titer를 측정하는 방법을 최초로 개발하였다. Plaque란 바이러스감염에 의하여 세포 변성을 일으킨 단층세포부위로서, plaque 주위의 감염되지 않은 정상세포는 vital dye로 염색되므로 구별된다. 각 세균마다 특징적인 colony가 만들어지듯이 각 바이러스마다 크기와 모양이 다른 특징적인 plaque가 생성된다. 한 개의 감염성이 있는 바이러스입자는 하나의 plaque를 형성한다는 이론 하에 plaque counting은 각종 바이러스의 정량에 응용되었으며, Dulbecco는 1975년 노벨 생리학상을 받음으로서 plaque assay의 중요성이 입증되기도 하였다.
실험 방법
1. Vero 세포주 seeding
1) 분석 전날, Herpesvirus에 대한 적절한 숙주 세포(Vero 세포주)를 90 - 100% 융합이 되게 플레이트 한다.
2) dH2O 에 10% 포름알데히드의 고정 용액을 준비한다. 예를 들어, 5.56㎖의 36% 스톡 포름알데히드와 14.44㎖의 증류된 H2O(dH2O )를 섞는다. (포름알데히드를 사용할 때는 적절한 안전 취급 관행과 환기를 해야함)
3) 크리스탈 바이올렛 염색 준비: 1% 크리스탈 바이올렛(CV) (in 20% 에탄올 및 dH2O)
4) 2x 플라크 매체를 준비한다. 시약이 멸균되지 않은 경우 0.2 ㎛ 필터를 사용하여 필터링한다.
5) 고정 오버레이의 준비
① 액체 오버레이의 경우 dH2O 에 Avicel의 멸균 2.4% 용액을 만든다. 덩어리를 방지하기 위해 교반 막대로 빠르게 혼합되는 물이 담긴 플라스크에 분말을 추가하고 Avicel을 천천히 붓고 실온(RT)에서 빠르게 교반한다.
② 균질화 후 용액을 오토클레이브하고(고압증기멸균) 실온에서 밀봉하여 보관한다.
③ 아가로스 및 카르복시메틸 셀룰로오스(CMC) 오버레이의 경우 2% CMC 또는 0.6% 아가로스의 dH2O 에서 스톡 솔루션을 준비한다. 교반 막대와 오토클레이브 또는 전자레인지로 혼합하여 용액에 넣는다.
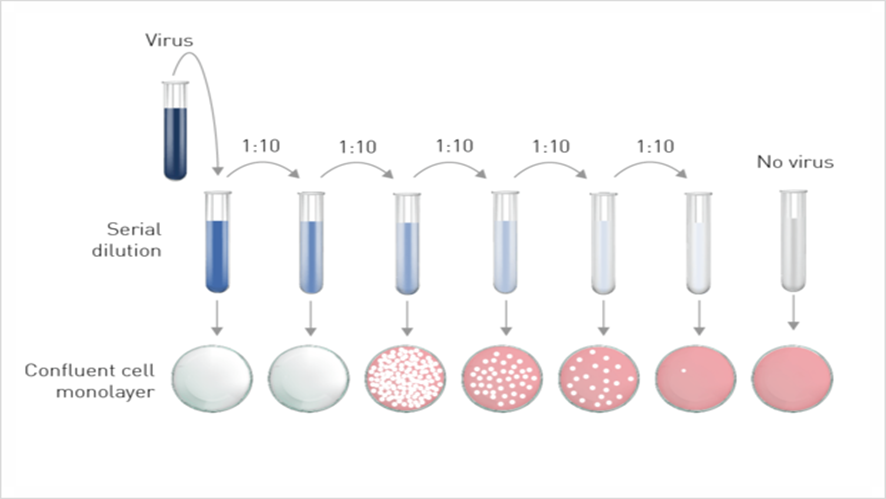
2. 희석 및 감염
1) 플레이팅 다음 날, 분석을 시작하기 전에 세포의 융합성과 생존성을 시각적으로 확인한다. 표준 세포 형태와 ~90% 융합 단층이 존재하는지 확인한다.
2) 감염성 샘플의 10배 연속 희석을 수행한다. 희석제로 바이러스 증식을 위한 세포 성장 배지를 사용한다. 해당 바이러스의 예상 역가에 따라 필요한 희석 수를 변경하고 항상 감염되지 않은 대조군 샘플을 사용하여 독립적으로 세포 생존을 보장하고 플라크 식별을 돕는다.
3) 연속 희석에서 45분에서 1시간 동안 세포를 감염시킨다. 단층과의 바이러스 접촉을 최대화하기 위해 가능한 한 낮은 부피를 유지하면서 세포를 덮기 위해 충분한 양의 접종원을 사용한다. 20분마다 플레이트를 부드럽게 흔들어 균일한 적용 범위를 보장하고 세포 단층이 건조되는 것을 방지한다.
4) 감염 후 2x 플라크 미디어와 고정 오버레이(CMC, 아가로즈 또는 Avicel)의 1:1 믹스를 사용하여 웰의 접종원에 직접 적절한 양의 고정 배지를 오버레이한다. 부드럽게 흔들어 섞는다. 아가로스 오버레이의 경우, 가온된 2x 플라크 매체와 가열된 0.6% 아가로스의 스톡 용액의 1:1 혼합물을 사용하고 56°C 수조에 30분 동안 놓아 온도를 평형화하여 0.3%의 최종 아가로스/오버레이 농도를 얻는다.
5) 오버레이를 추가한 후 플레이트를 배양하여 명확하게 셀 수 있는 별개의 플라크를 생성한다. 플라크 형성은 분석되는 바이러스에 따라 2-14일이 소요될 수 있다.
3. 세포 고정 및 염색
1) Avicel 오버레이를 부은 후 10% 포름알데히드 용액을 사용하여 세포를 고정한다.
2) 염색 전과 고정 후 포름알데히드를 버리고 흐르는 물이나 주걱으로 아가로스 및 CMC용 반고체 플러그를 제거한다.
3) 염색 전에 잔류 오버레이/고정제를 제거하기 위해 물로 Avicel 플라크를 헹군다. 염색을 위해 15분 동안 최소량의 크리스탈 바이올렛 용액으로 세포를 덮는다.
4) 크리스탈 바이올렛을 물로 부드럽게 씻어낸다. (고정, 염색 및 건조 후에는 향후 분석을 위해 플라크를 무기한 보관)
4. Plaque counting 및 바이러스 역가 측정
1) 동일한 희석의 기술 복제에 대한 평균을 취하여 각 웰의 플라크를 계산한다.
2) 대형 플레이트 형식의 경우 5개 미만 또는 100개 이상의 플라크가 있는 웰은 무시한다. (플라크 크기와 형태를 기록)
3) 음성 대조군은 균일한 단층이 있어야 하며 참조 대조군으로 사용할 수 있다.
4) 희석에 대한 플라크의 평균 수와 총 희석 계수의 역수를 취하여 스톡 샘플의 바이러스 역가를 결정한다.
[병원미생물학실험]Herpesvirus의 Plaque assay 레포트
1. 실험 이론 및 원리 1.1. 실험 배경 바이러스 titer의 측정은 바이러스의 중화시험, 항바이러스제에 대한 감수성검사, 바이러스정제 시의 순수성 평가, 바이러스의 병인성 평가 시에도 가장 기본...
www.happycampus.com


댓글