산화-환원 반응을 이용한 갈바니 전지를 만들어 보고 이를 통해 실생활에 쓰이는 전지에 대해 이해한다.
전기화학 전지의 종류
전기화학 전지는 화학에너지와 전기에너지를 상호 변환하여 에너지를 발생시키는 장치이다.
갈바니 전지(=볼타 전지)는 자발적 화학반응으로 전류가 발생하고 전해 전지는 전류를 이용하여 비자발적 반응이 발생한다. 화학전지로 만들어진 실용전지들의 예는 다음과 같다.
1. 1차 전지 : 건전지, 산화은 전지, 알칼리 전지, 리튬 전지 등
2. 2차 전지 : 납축전지, 수은전지, 니켈카드뮴 전지, 연료전지 등
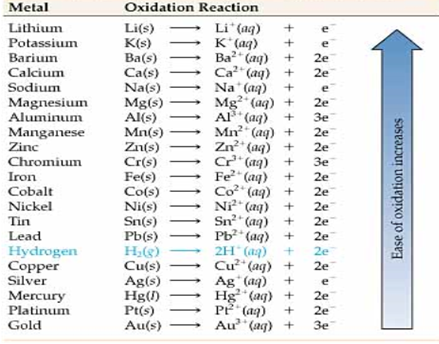
이온화경향
금속이 수용액에서 전자를 잃고 양이온이 되려는 성질로 이온화 경향이 클수록 전자를 잃기 쉽다.
이온화 경향 순서 : K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H) > Cu > Hg > Ag > Pt > Au
또한, 두 금속의 이온화 경향의 차가 클수록, 전지의 기전력은 커진다. 서로 다른 2종류의 금속과 전해액을 조합하여 만들어진 전지에서
1. 이온화 경향이 큰 쪽의 금속 → 음극
2. 이온화 경향이 작은 쪽의 금속 → 양극
화학전지(Electrochemical cell)
화학 반응이 일어날 때 발생되는 에너지를 전기 에너지로 전환시키는 장치로, 화학 전지에 이용되는 반응은 발열 반응이며, 산화-환원 반응이다. 화학전지의 (-)극에서는 산화 반응이 일어나면 (+)극에서는 환원 반응이 일어난다. 이러한 반응에서 전자의 흐름이 발생하는데 이를 이용하는 것이 화학전지이다.
실험 방법
1. 실험 과정
1) 순도 99%의 0.1M CuSO4 250㎖, 순도 99%의 0.1M ZnSO4 250㎖, 순도 99%의 0.05M CuSO4 250㎖, 순도 99%의 0.05M ZnSO4 250㎖를 각각 제조한다.
2) 1의 용액들을 각각 2개의 비커에 100㎖식 나눠담고 0.1M CuSO4-0.1M ZnSO4, 0.1M CuSO4-0.05M ZnSO4, 0.05M CuSO4-0.1M ZnSO4, 0.05M CuSO4-0.05M ZnSO4로 짝을 지어준다.
3) CuSO4용액이 들어있는 비커들에 구리판을 넣고 ZnSO4용액이 들어있는 비커들에 아연판을 넣는다.
4) U자관을 준비한다. agar reagent와 KCl의 포화 수용액을 만들고 U자관에 넣는다.
5) U자관으로 두 개의 비커를 연결한다.
6) 각각의 전극의 전위를 측정한다.
[일반화학실험]화학전지와 열역학 레포트
1. 실험 목적 가. 산화-환원 반응을 이용한 갈바니 전지를 만들어 보고 이를 통해 실생활에 쓰이는 전지에 대해 이해한다. 2. 실험 이론 및 원리 가. 전기화학 전지의 종류 전기화학 전지는 화학에...
www.happycampus.com


댓글