산성비
산성비란 말은 1872년 영국의 화학자이며 기후학자인 Robert Angus Smith에 의해서 처음 사용되었다. 그는 산업혁명 초기에 영국의 Manchester에 내렸던 산성 강우를 나타내기 위하여 이 말을 사용하였다. 중성 물의 pH는 7이지만 빗물은 정상적인 대기 중에 들어 있는 이산화탄소가 녹아서 자연적으로 산성을 띠게 된다. 이산화탄소는 가역적으로 물과 반응하여 약산인 탄산 용액을 만든다.

평형상태에서 공기 중의 CO2가 물에 용해된 용액의 pH는 약 5.6이며 따라서 pH가 5.6 이하인 비를 산성비(acid rain)라 한다. 천연으로나 산업적으로 만들어지는 이산화질소(NO2)는 대기 중에서 물과 반응하여 질산(HNO3)이나 아질산(HNO2)이 된다.

이산화황(SO2)은 산소와 물이 존재하면 황산(H2SO4)이 된다.

Greenland에서 얻어진 1900년경에 생성된 것으로 추정되는 얼음 조각에는 황산이온(SO42-)과 질산이온(NO3-)을 포함하고 있었다. 이는 적어도 1900년도 이후에 산성비가 자주 내렸다는 것을 뜻한다. 근래의 산성비는 인간 활동에 의해 생성되는 다량의 산성산화물이 대기 중에 배출되기 때문에 생긴다. 이러한 산성 강우가 특정 지역에 내려 심각한 환경 문제가 발생한다. 미국의 동북부 지역과 유럽의 동북부 지역 강우의 연평균 pH 값은 4~4.5이다. West Virginia와 같은 특정 지역에서의 강우는 한때 pH 값이 1.5라는 낮은 값을 기록하기도 하였다. 눈이나 비는 국경선이 없다. 미국에서 생성된 산성비가 캐나다의 도시나 삼림지역에 내려 많은 캐나다 주민들이 미 정부에 항의를 하고 있다.

산성비의 비참한 현상은 물고기가 없는 연못이나 호수, 죽어가거나 죽은 숲들 그리고 무너져가는 건물 등에서 볼 수 있다. 노르웨이와 스웨덴은 풍향 때문에 서유럽에서 배출되는 황산화물과 질소산화물을 산성비의 형태로 받게 된다. 그 결과로서 스웨덴에 있는 100,000개의 호수 중에서 4,000개는 물고기가 없는 호수가 되었고 14,000개 호수는 어느 정도 산성화되었다.
미국의 예를 보면 뉴욕의 Adirondack 산맥에 있는 연못과 호수의 6%가 물고기들이 살 수 없으며 미시간의 200여 호수도 죽은 호수가 되었다. 이러한 죽은 호수의 대부분은 그림 같이 아름답게 보이지만 어떤 물고기도 이 산성화된 물에서는 살수가 없다. 호수에 사는 숭어와 황색 농어는 pH 5.0 이하에서 죽고 입 작은 농어는 pH 6.0 이하에서 죽으며 또한 홍합은 pH 6.5 이하에서 죽는다.
산성비는 나무에 많은 피해를 준다. 산성비는 나뭇잎의 증발작용을 증가시킴으로써 나무의 수분부족 현상을 야기시킨다. 산성비는 토양을 산성화시키고 식물의 실뿌리에 해를 입혀 양분과 물의 흡수를 감소시킨다. 산은 필요한 토양의 광물질을 걸러내고 이 걸러진 광물질은 지하수로 흘러 들어간다. 산성비의 양성자(H+)는 토양 중에 있는 불용성의 수산화알미늄과 반응하여 물에 녹는 알미늄 이온(Al3+)을 만들고 이것을 식물의 뿌리가 물과 함께 흡수하면 독성에 의해 해를 입게 된다.

산성비는 석조 또는 금속 구조물을 황폐화시킨다. 유럽의 석조건물을 예로 보면 산성비는 대륙의 역사적 유물들을 서서히 융해시키고 있다. 서독의 Cologbe 성당의 새김글씨는 겨우 인식할 수 있을 정도이다. 런던 탑, 성 바오로 성당, 런던의 Lincoln 성당도 역시 같은 운명으로 피해를 입고 있다. 유럽과 미국 동부와 캐나다 등에 있는 아름답게 조각된 동상과 새김글씨들도 산성비의 작용에 의해 서서히 사려져 가고 있다. 현재 산성비의 대응책으로 석회,Ca(OH)2,를 산성화된 호수에 뿌려 산을 pH 7 근처로 중화시키는 임시방편의 방법이 사용되고 있다.

스웨덴은 자국 내의 몇몇 호수를 중화시키는데 연간 4천만 달러를 소비하였다. 그런데 산성비 지역의 몇몇 호수들은 산성을 중화시킬 수 있는 탄산칼슘(CaCO3)이 호수 바닥에 있어서 자연적으로 산성비에 대응하여 보호되기도 한다.
산성비 문제의 궁극적인 해결책은 국가차원에 있다. 1985년에 유럽 21개국은 SO2 방출을 31% 이하로 줄이자는 10개년 계획에 동의하였다. 1989년에 절반 이상의 국가가 이미 이 목표에 도달하였다. 1988년에 캐나다 정부는 SO2 방출량을 1994년까지 절반으로 줄이자는 목표를 세우고 미국을 비롯한 많은 나라에 협조를 요구하고 있다.
클로로플루오로카본(CFCs)과 오존층
대부분의 오염물질은 대류권(troposphere)의 영역에서 일어나는 반응에 의하여 대기로부터 제거된다. 즉 오염 물질들은 원자, 분자 또는 이온과 같은 입자에 흡착되거나 물방울에 흡수되면 침전으로 제거될 수 있다. 또 오염물질들은 기체상에서나 용액내에서 화학 반응을 일으킬 때 덜 해로운 물질로 변할 수 있다.
그러나 염소, 플루오르 및 탄소로 이루어진 클로로플루오르카본(chlorofluorocarbons, CFCs)은 비활성이므로 오랜 기간 동안 대기 중에 남아 있을 수 있다. 예를 들면 CFC-12, CF2Cl2의 분자는 거의 100년 동안 대기 중에 머물러 있다. CFCs는 대류권 전역에서 공기와 섞여 15~50㎞사이의 성층권(stratophere)으로 이동한다. 그리고 그곳에서 자외선에 의해 분해된다. CFCs의 분해물은 성층권 내의 반응에 참여하는데 특히 오존의 농도를 감소시킨다.
CFCs는 냉매로 에어컨에 사용된다. CFCs는 이것이 합성되기 전에 사용되었던 암모니아나 이산화황보다 더 효과적이고 안전하다. 그리고 CFCs는 전자분야나 기계금속 분야에서 다양한 제품을 제조하는데 용매로 사용된다. 1978년 미국에서 CFCs의 사용을 금지하기 이전까지 저분자량의 CFCs는 헤어스프레이를 포함한 연무제, 탈취제, 의약, 식품을 위한 추진제 등으로 사용되었다. 지금도 CFCs는 선진국이나 개발도상국 등 세계 전역에서 여전히 사용되고 있다. CFCs가 많이 이용되고 있는 주요 이유는 이것이 갖고 있는 난연성과 불활성 때문이다.
1974년 Molina와 Rowland는 CFCs의 계속적인 사용은 성층권 오존층의 오존 감소로 심각한 현상을 가져올 것이라고 지적하였다. 성층권에 있는 오존은 지구 표면으로 오는 태양의 근 자외선(200~300㎚)을 95~99%까지 차단한다. 이 200~300㎚ 범위에 있는 광자는 사람에게 피부암을 유발시키고 식물에게는 해를 입힐 수 있을 만큼 충분한 에너지를 갖고 있다. 성층권의 오존이 1% 감소할 때마다 해로운 자외선이 지구표면에 도달하는 것은 2% 증가한다. 그래서 오존의 감소는 우리의 환경을 엄청나게 해칠 수 있는 잠재력을 갖고 있다. CFCs에 의한 오존층의 파괴는 매우 큰 에너지를 가진 광자가 CFC 분자의 탄소-염소 결합을 끊을 때 시작된다.

위 반응에서 생성된 염소원자는 소위 연쇄반응 메카니즘에 참여한다. 이것은 먼저 오존 분자와 결합하여 산화염소(ClO) 라디칼과 산소분자를 만든다.
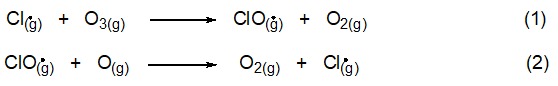
이 두 단계를 더해서 얻어진 알짜 반응은 한 개의 오존 분자와 한 개의 산소원자가 두 개의 산소분자로 전환되는 것이다.

이 연쇄반응으로 성층권 오존의 파괴 속도는 증가시키나 오존의 생성속도에는 영향을 주지 않는다. 한 개의 Cl 원자는 활성이 없어지거나 대류권으로 돌아가기 전까지 100,000개나 되는 많은 O3 분자를 파괴할 수 있다. 오존을 파괴하는 반응의 촉매 작용은 성층권에서의 균형을 무너뜨린다. 이는 오존이 생성되는 것보다 파괴되는 것이 더 빠르기 때문이다.
1985년의 영국 남극 조사단은 9월과 10월 남극 오존의 농도가 놀랄 정도로 감소된 오존홀에 대해 보고하였다(그림 4 참조). 몇몇 연구팀에 의한 계속적인 측정은 오존의 손실과 ClO의 높은 농도가 오존홀과 관련이 있다는 것을 보여주었다. 이것은 Cl 원자를 포함하는 연쇄반응 메카니즘에 그 원인이 있다고 하는 이론을 지지해준다. 그러나 남반구 오존의 큰 감소는 단지 위의 염소원자의 연쇄반응에 의해서만 설명될 수 없다. 따라서 또 다른 설명은 다음과 같다.
남반구의 겨울에는 얼음 결정을 포함하고 있는 매우 찬 공기의 소용돌이가 만들어지고 여기서 HCl과 ClONO2의 첨가반응으로 Cl2 분자를 만들 수 있다.

봄이 되어 일광이 다시 돌아오면 이 Cl2 분자는 Cl 원자로 쉽게 광분해되고 이것은 다시 오존 파괴반응에 관여할 수 있다.

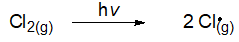
염소원자가 오존 파괴에 관여한다는 이론을 지지하는 특별히 강한 증거를 [그림 5]에 나타내었다. NASA의 연구용 항공기가 오존홀 속으로 날아가면서 이 비행기에 탑재된 기기로 ClO와 O3의 농도를 동시에 측정하였다. 이 결과 오존홀 내의 ClO 농도는 외부보다 훨씬 높고 O3의 농도는 훨씬 낮다는 것을 확인하였다. 즉 오존이 소모되는 반응에서 ClO가 생성되는 것을 잘 설명하고 있다. 이것은 Cl과 O3가 반응하여 ClO와 O2를 생성하는 오존 파괴 메카니즘의 반응(1)에 해당한다.
1988년까지 인공위성과 지상에서 측정한 결과로는 세계의 오존층이 평균적으로 약 2.5% 감소하였다. 극지방에서의 감소는 이보다 훨씬 더 크다. Dublin, Moscow, Anchorage의 오존은 1969년 1월에서 1986년 1월까지 약 8%가 감소하였다. 이 감소 원인은 약 80%가 CFCs에서 나온 Cl 원자에 의한 것으로 생각된다.

CFCs에 의한 성층권 오존층의 피해를 줄이기 위한 노력으로, 1987년 Montereal에서 회의가 열렸다. 그리고 1989년 1월에는 오존층을 감소시키는 물질에 대한 처리 내용이 담긴 Montereal 의정서에 합의하였다. 36개국에 의해 합의된 그 의정서에는 먼저 수명이 긴 CFCs의 생산과 소비를 감소시키도록 요구하였다. 1990년 London에서, 1992년 Copenhagen에서 각각 조인된 조약은 지금도 여전히 효력을 가지고 있는데, 이는 오존층에 해를 끼칠 수 있는 모든 화학 제품의 완전 폐기를 요구하고 있다. 1992년 미국 EPA는 자동차 에어컨용으로 사용되는 CFCs의 작은 용기(20 파운드 이내) 판매를 금지시켰고, 주유소에서 CFCs를 방출하지 못하도록 하였다.
이와 같은 추세로 볼 때 오존의 농도에 영향을 미치는 CFCs의 사용은 2,000년 이후부터 감소되기 시작할 것으로 전망된다. CFCs가 사용 중지될 것이 명백해진 이후에 제조업자들은 이것의 대용품을 찾기 시작하였다. 가능한 CFCs의 대체물 중 한 종류는 HCFCs라 불리는 분자이다. 이것은 탄소, 플루오르 및 수소만을 갖고 염소원자를 포함하지 않는다. 현재로서는 HCFCs가 CFCs을 대용할 수 있는 가장 좋은 물질이다(표 3 참조).

[Chemistry/생활 속 화학] - 대기 오염의 화학 | 대기의 중요성
[Chemistry/생활 속 화학] - 대기 오염의 화학 | 대기권의 구조
[Chemistry/생활 속 화학] - 대기 오염의 화학 | 대기의 성분
[Chemistry/생활 속 화학] - 대기 오염의 화학 | 대기오염 - 1부
[Chemistry/생활 속 화학] - 대기 오염의 화학 | 대기오염 - 3부
[일반화학]대기 오염의 화학 레포트
1. 대기의 중요성 대기는 지구상의 모든 생물의 삶과 성장을 담당한다. 즉 지구상에 존재하는 모든 생물의 호흡에 필요한 산소를 제공해준다. 녹색식물은 대기 중의 이산화탄소를 이용하여 유기물을 합성하면서 성장하고 다른 생물들은 이 합성된 유기물을 섭취하며 살아간다. 또한 대기는 질소 고정 박테리아와 암모니아 생성 박테리아가 생존에 필요한 질소 화합물을 합성할 수 있도록 질소를 제공해준다. 콩과식물의 좋은 질소비료원은 질소 고정 박테리아가 합성한 질소화합물이
www.happycampus.com


댓글