
원자의 개념에 대한 역사
1. 그리스 철학의 원자론 및 원소 설
물질의 근원이 무엇인지는 인류 문명이 시작되면서 가지게 된 근원적인 의문들 중 하나다. 원자론은 고대 그리스의 데모크리토스 학파 철학에서 처음 나타났는데, 이 때의 원자론은 순전히 철학적 사유의 결과였다. 즉 물체를 쪼개고, 그 조각을 다시 쪼개는 과정을 무수하게 반복하였을 때 더 이상 쪼갤 수 없는 궁극적인 한계가 있을 것이라는 가정을 하고, 더 이상 쪼개지지 않는 가장 작은 단위인 원자(Atom)라는 존재를 주장하였다. 그러나 고대의 원자론은 과학적인 사실에 바탕을 둔 것이 아니었으며, 이것을 실험으로 검증하려는 시도가 없었고 자연 현상에 대한 실증적인 연구에 적용되지도 않았다.
또 한편 복잡한 자연의 여러 현상들을 보다 간단하고 체계적으로 설명하기 위하여 우주를 이루는 모든 것들은 단지 몇 가지의 기본적인 원소들만으로 이루어 졌다고 설명하려는 학설이 고대 그리스에서 시도 되었다. 그러한 배경에서 물, 불, 흙, 공기의 네 가지 원소들로 우주 만물이 이루어졌다는 4원소설이 성립하였으며, 나중에 천상의 존재를 설명하기 위한 다섯 번째 원소가 추가 되었다.
이렇게 성립된 원소 설은 근대 과학이 성립되기까지 2천년 이상 지속 되었다. 특히 모든 물질이 단지 네 가지 원소만으로 이루어 졌다는 이론은 물질 속에 든 네 원소의 비율만 바꾸면 한 물질에서 다른 물질을 만들 수 있다고 믿게 하였으며, 이러한 믿음을 바탕으로 하여 물질 사이의 변화를 연구하는 연금술이 약 2000년 동안 화학의 역할을 대신 하였다.
2. 현대 화학의 시작
현대 화학은 16-17 세기에 이르러 비로써 시작 되었다. 로버트 보일(Robert Boyle; 1627-1691)은 공기의 압력과 부피 사이의 관계를 연구 하면서 진정한 의미의 정량적인 화학 실험을 최초로 실시하여 정성적인 실험에 머물렀던 연금술을 벗어나 화학을 정량적인 과학으로 발전시키는 계기를 마련하였다. 보일은 특히 4 원소 설에 직접적인 의심을 제기하였는데, 한 물질이 화학반응을 통하여 두 가지 이상의 다른 물질들로 분해 되지 않는 한 그 자체가 원소라는 생각을 제시 하였다.
원소에 대한 보일의 정의는 원소를 철학적인 개념이 아니라 실제 실험에 근거하여 정의하자는 것이었으며, 이러한 보일의 생각이 일반적으로 받아들여지기 시작하면서 원소의 수는 증가하기 시작하였다. 특히 프리스틀리(Joseph Priestley; 1733-1804)는 공기에서 산소를 따로 분리하여 4원소설의 기본 원소 중 하나이던 공기가 사실은 여러 가지 성분의 혼합체라는 것을 1774년에 실험으로 증명하였다. 이에 따라 4 원소 설은 더 이상 과학에서 받아들여지지 않게 되었다.
3. 정량적인 법칙들의 발견
보일의 뒤를 이어 현대화학의 기초를 이룩한 사람은 현대 화학의 아버지로 불리는 라보아제(Antoine Lavoisier; 1743-1794)다. 그는 화학 실험에서 정량적인 측정의 중요성을 강조 하였으며, 실제의 다양한 화학 반응 실험에서 반응물과 생성물의 질량을 정밀하게 측정하여 ‘물질은 화학 반응을 통하여 창조되지도 않고 소멸되지도 않는다’는 질량보존의 법칙을 확립하였다. 또한 연소 과정에는 산소가 참여한다는 것을 입증하여 17-18세기동안 논란이 되어왔던 연소 현상을 올바르게 과학적으로 규명하였으며, 생명현상의 여러 반응들에는 연소 반응과 비슷하게 산소가 관여함을 보였다.
라보아제의 뒤를 이어 여러 화학자들이 화학반응에 관한 여러 정량적인 법칙들을 발견하였다. 프르스트(Joseph Proust; 1754-1826)는 ‘특정 화합물 내에 포함된 원소들의 질량비는 항상 동일하다’는 일정성분비 법칙을 발견하였는데, 이것은 화합물이 일정한 조성을 갖는다는 것을 의미한다. 예를 들어 어느 화합물에 A와 B라는 두 원소가 각각 30%와 70%씩 들어 있다면, 이 화합물은 어떤 방식으로 제조되거나 어떤 곳에서 발견되어도 그 안에 포함된 A와 B 두 원소의 질량비는 항상 30%와 70%라는 것이다. 즉 원소들 사이의 혼합이 마구잡이로 섞이는 것이 아니라 일정하게 정해진 비율에 따른다는 의미다.
또 한편 돌턴(John Dalton; 1766-1844)은 ‘두 원소가 여러 가지 다른 화합물들을 형성할 때, 특정원소 1g과 결합하는 다른 원소의 질량들 사이에는 간단한 정수비가 성립 한다’는 배수비례 법칙을 발견하였다. 예를 들어 산소와 탄소만으로 이루어진 두 화합물이 있는데, 첫 번째 화합물에서는 산소 1g과 결합한 탄소의 질량이 0.375g인 반면에 두 번째 화합물에서는 산소 1g 당 탄소가 0.75g 결합하고 있어서 0.375g과 0.75g 사이에는 1:2의 정수비가 성립한다.
4. 돌턴의 원자설
자연 현상을 관념적인 사유가 아니라 직접 실증적인 관찰과 실험 결과에 바탕을 두고 인간의 이성으로 이해하려는 근대의 과학인 연구가 진행되면서 고대의 원소 설은 많은 문제를 일으킨다. 우선 고대의 원소 설에서 기본 원소의 하나로 생각하였던 공기가 사실은 여러 가지 성분으로 분리될 수 있는 혼합물이라는 것이 밝혀지고 4 원소설이 폐지되기 시작하면서 보일에 의하여 제시된 원소의 개념이 받아들여졌다. 이러한 바탕 위에서 화학 반응에 대한 18세기 동안에 발견된 여러 가지 정량적인 법칙들을 설명하기 위하여 1808년 돌턴은 다음과 같은 원자설을 제시하였다.
1. 각 원소는 원자라는 더 이상 쪼개지지 않는 작은 입자로 이루어져 있다.
2. 동일한 원소의 원자는 질량이 모두 동일하고 다른 원소의 원자는 질량이 완전히 다르다. 즉 원자를 구별하는 특징은 원자의 질량이다.
3. 다른 원소의 원자들이 서로 간단한 정수비로 결합하여 다양한 화합물을 만든다. 그러나 특정 화합물에는 언제나 동일한 원자들이 일정한 비율로 존재한다.
4. 원자들이 재배열 되는 것이 화학 반응이다. 화학 반응에서 원자 자체는 변하지 않는다.
돌턴의 원자설의 기본 가정들 중 몇 가지는 올바르지 않다는 것이 나중에 밝혀지기는 하였지만, 돌턴의 원자설은 질량보존 법칙, 일정성분비 법칙, 배수비례 법칙에 대한 합리적인 설명을 제공 하였다. 또한 현대의 원자 개념의 기본 틀을 제공하는 중요한 역할을 하였다.
서로 다른 원소들 사이의 질량 비율을 실험으로 정하는 방법을 제공하였기 때문에 돌턴은 최초의 ‘원자 질량 표’를 만들었다. 그러나 그 당시까지는 원자와 분자를 구별하는 개념과 방법이 명확하지 않았기 때문에 돌턴의 원자 질량표는 많은 부분이 잘못된 것들 이었다. 예를 들어 물은 수소와 산소로 이루어 졌다는 사실은 알았지만 수소와 산소의 비율이 1:1일 것으로 믿었기 때문에 수소의 질량을 1로 할 때 산소의 질량이 8이 된다고 잘못 생각 하였다.
5. 화학식 표시법의 확립
동일한 온도와 압력에서 반응하는 기체들의 부피를 측정하는 실험을 통하여 1809년 게이루삭(Joseph Gay-Lussac; 1778-1850)은 기체 반응의 법칙을 발견하였다. 그림 2.1은 동일한 온도와 압력 조건에서 수소기체 2 부피와 산소기체 1 부피를 반응시키면 수증기 기체 2부피를 생성되며, 수소 1 부피는 염소 1 부피와 반응하여 염화수소 2 부피를 만드는 것을 보여준다. 이것은 서로 다른 원소들이 결합하는 반응에서 원소들 사이의 비율에 일정한 법칙이 있다는 것을 의미한다.
이러한 실험 결과를 해석하기 위하여 아보가드로(Amadeo Avogadro; 1776-1856)는 ‘온도와 압력이 동일하면 동일한 부피 속에 들어있는 기체 단위체(분자)의 수는 기체의 종류에 관계없이 일정하다’는 아보가드로 가설을 1811년에 제시하였다. 아보가드로 가설을 받아들인다면, 그림 2.1에 나타낸 게이루삭의 두 번째 실험은 수소기체의 단위체 하나와 염소기체의 단위체 하나가 반응하여 염화수소 기체의 단위체 2개를 만든다는 것을 의미한다.
만약 수소와 염소 기체의 단위체가 각각 수소원자 하나와 염소원자 하나로 이루어졌다면, 두개의 염화수소 단위체를 만들기 위해서는 수소 원자와 염소 원자가 각각 반으로 쪼개진 뒤 그 반쪽들끼리 결합하여 염화수소 기체의 단위체를 2개 만들어야 한다. 그러나 원자는 더 이상 쪼개지지 않는다는 돌턴의 원자설을 받아들인다면 그림에 보인 것처럼 수소와 염소기체의 단위체는 각각 2개씩의 수소와 염소 원자로 이루어진 것으로 가정하여야 함을 알 수 있다. 또한 그러한 가정에 따르면 그림 2.2의 첫 번째 보인 것과 같이 수증기 기체의 단위체는 산소원자 하나와 수소원자 두개가 결합한 것으로 가정할 수 있다.
이러한 실험결과의 해석은 수소, 산소, 염소 기체의 단위 입자들은 2개의 원자로 이루어 진 반면 수증기의 단위 입자는 산소원자 하나와 수소원자 2개의 비율로 이루어 졌다는 것을 다는 것을 이해하도록 하였다. 이와 같이 두 가지 이상의 원소로 이루어진 물질의 기본 단위를 원자와 구별하여 분자(Molecule)라 부르기로 하였으며, 이를 바탕으로 원자들 사이의 올바른 질량비를 결정할 수 있었고, 화학식을 올바르게 정할 수 있었다. 이러한 발전을 바탕으로 베르셀리우스(Jones Jakob Berzelius; 1779-1848)는 화합물의 화학식을 표기하기 위한 현대적인 원소 기호를 고안하였다.
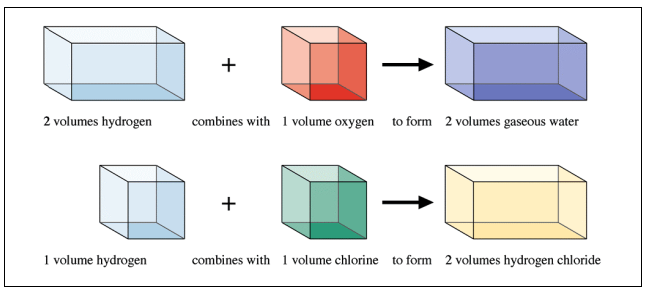
그림 2.1 기체 반응의 법칙에 해당하는 실험. 수소 2 부피가 산소 1 부피와 반응하여 수증기 2 부피가 생성되며, 수소 1 부피와 염소 1 부피와 반응하여 염화수소 2 부피가 생성되는 것을 보여주는 실험.
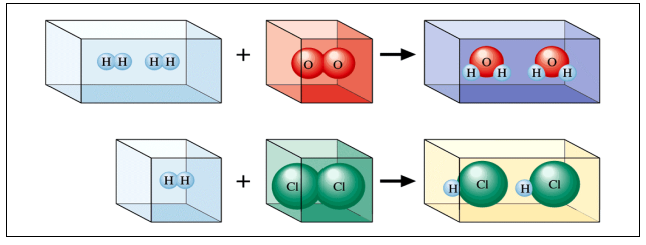
그림 2.2 원자는 더 이상 쪼개지지 않는다는 돌턴의 원자설과, 기체의 부피와 입자의 수는 비례한다는 아보가드로의 가설을 바탕으로 하여 그림 2.1의 시험을 설명하는 그림.
[Chemistry/일반화학] - 일반화학개론 | 화학을 시작하기 전에
[Chemistry/일반화학] - 일반화학개론 | 화학결합과 분자구조
[Chemistry/일반화학] - 일반화학개론 | 몰의 개념과 농도
[Chemistry/일반화학] - 일반화학개론 | 여러가지 화합물
[Chemistry/일반화학] - 일반화학개론 | 화학 반응과 화학 양론
[일반화학]원자의 구조와 주기성 레포트
1 원자의 개념에 대한 역사 그리스 철학의 원자론 및 원소 설 물질의 근원이 무엇인지는 인류 문명이 시작되면서 가지게 된 근원적인 의문들 중 하나다. 원자론은 고대 그리스의 데모크리토스...
www.happycampus.com


댓글