다음의 표는 화학결합에 따라 화합물의 특성이 얼마나 달라지는지를 잘 보여주는 한 예이다. 우리의 식탁에 없어서는 안 될 소금(NaCl, 염화나트륨)과 유기용매로 사용되는 사염화탄소(CCl4)는 모두 염소 원자를 포함하고 있지만 그 특성은 매우 다르다. 사염화탄소의 녹는점은 -23℃로 상온에서 액체 상태로 존재하지만 소금의 녹는점은 801℃로 상온에서 고체 상태이다. 또한 소금은 물에 잘 녹지만 사염화탄소는 물에 거의 녹지 않는다. 이러한 차이는 두 화합물의 결합방식이 서로 다르기 때문에 나타나는 것이다.
| 성질 | NaCl | CCl4 |
| 상온에서 상태 녹는점 (℃) 끓는점 (℃) 밀도 (g/㎤) 물에 대한 용해도 액체 상태에서 전기전도도 |
흰색 고체 801 1413 2.17 높음 높음 |
무색의 액체 -23 76.5 1.59 매우 낮음 낮음 |
표 1 이온결합 화합물과 공유결합 화합물의 몇 가지 성질의 비교
원소들 사이에 화학결합이 어떤 방식으로 형성되는지 알 수 있는 간단한 원리를 배우게 된다. 우리는 또한 이러한 결합방식이 화합물의 특성을 어떻게 결정하는지 알게 될 것이다. 특히 공유결합으로 형성되는 분자의 경우에는 그 분자의 구조가 성질을 결정하는 중요한 단서가 되기 때문에 분자의 구조를 예측하는 방법도 살펴볼 것이다.
1. 팔전자 규칙
우리는 원자의 구조에서 원소들의 화학적 성질이 주기적으로 변하는 이유가 바로 전자배치가 주기적으로 변하기 때문이라는 것을 배웠다. 예를 들어 알칼리 금속으로 알려진 1A 족의 원소들은 모두 s 오비탈에 전자가 한 개 채워진 상태로 끝나고 할로겐 원소들인 7A족은 모두 p 오비탈에 전자가 5개 채워진 상태로 끝난다. 이와 같은 주기성을 더욱 단순하게 생각하는 방법은 원자가껍질이라는 개념을 이용하는 것이다. 원자가 껍질 (valence shell)은 전자가 채워진 가장 바깥 껍질을 가리킨다. 원자의 구조에서 여러분은 주양자수가 껍질을 결정한다는 것을 배웠을 것이다. 즉 주양자수가 1이면 1번 껍질이고 주양자수가 3이면 3번 껍질이다.
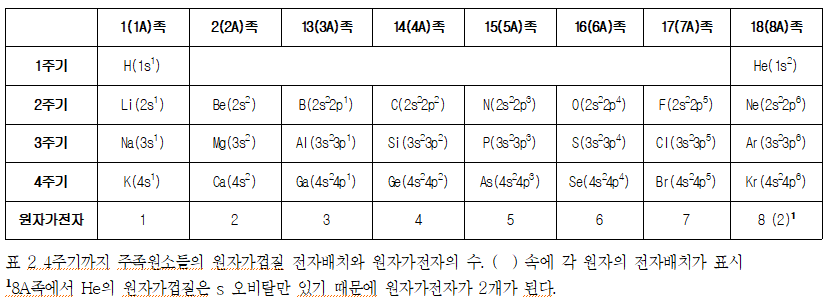
표 2에는 4주기까지 주족 원소들의 원자가껍질의 전자배치가 나타나 있다. 1주기의 수소와 헬륨은 주양자수가 1인 오비탈까지만 전자가 들어있기 때문에 원자가껍질은 1번 껍질이다. 2주기의 리튬부터 네온까지의 원소들은 전자가 들어있는 가장 마지막 오비탈의 주양자수가 2이기 때문에 원자가껍질은 2번 껍질이 된다. 이 원자가껍질에 있는 전자들은 원자가껍질 전자(valence shell electron) 또는 줄여서 원자가전자라고 부른다. 표를 보면 1A 족부터 8A족까지 원자가전자가 1부터 8로 증가하는 것을 볼 수 있다. 이 원자가전자의 수는 결합을 예측하는데 중요한 정보가 된다.
나중에 화학반응과 에너지 변화를 다루는 부분을 배울 때 자연의 모든 자발적인 변화는 더욱 안정하게 되려는 경향 때문에 일어난다는 것을 살펴보게 될 것이다. 화학결합도 동일한 원리의 적용을 받는다. 원소들은 더욱 안정하게 되려는 경향 때문에 결합을 형성한다. 8A 족에 속한 원소들은 이러한 원소의 안정성에 대한 중요한 통찰력을 제공해준다. 대부분의 원소들은 자연 상태에서 단원자 상태로 존재하지 못하고 결합을 형성한 상태로 존재한다. 예를 들어 수소, 산소, 질소 등은 두 개의 원자가 결합한 H2, O2, N2의 상태로 존재하고 금속원소들은 금속결합을 한 상태로 존재하며 탄소는 흑연이나 다이아몬드에서와 같이 여러 개의 탄소 원자들이 공유결합을 한 상태로 존재한다.
그러나 8A 족에 속한 원소들은 예외적으로 단원자 상태로 존재하며 다른 원소들과 잘 반응하지 않기 때문에 비활성기체 즉 화학적인 활성이 없는 기체라고 불리기도 한다. 우리는 이러한 현상을 통해 비활성기체들의 전자배치가 가장 안정한 상태이며 다른 원소들이 화학결합을 형성하는 이유는 바로 이와 동일한 전자배치를 갖기 위한 것이라는 일반적인 원칙을 이끌어낼 수 있다.
수소와 헬륨을 제외한 원소들의 원자가껍질을 채우기 위해서는 8개의 전자가 필요하기 때문에 원소들이 비활성기체와 같이 8개의 전자를 가지려는 경향을 팔전자 규칙 또는 옥테트 규칙 (octet rule)이라고 부르기도 한다. 수소의 원자가껍질은 2개의 전자를 수용하기 때문에 팔전자 규칙의 적용을 받지는 않는다. 따라서 더욱 일반적으로 말한다면 모든 화학결합은 원자들이 원자가껍질을 채우려는 경향 때문에 생겨난다고 할 수 있다.
2. 이온결합
팔전자 규칙에 의하면 나트륨 원자가 안정하게 되기 위해서는 3s 오비탈에 있는 전자를 하나 잃고 네온과 같이 되든지 아니면 7개의 전자를 얻어 3s와 3p 오비탈을 모두 채움으로써 아르곤과 같이 되어야 한다. 그러나 7개의 전자를 얻는 것은 어렵기 때문에 나트륨은 전자를 하나 잃고 +1의 전하를 갖는 양이온 즉 Na+이 되려는 경향을 가지게 된다. 반면에 염소 원자는 7개의 원자가 전자를 가지고 있기 때문에 전자 하나를 얻어 Cl- 음이온이 되려는 경향을 갖는다.

그림 1에서 볼 수 있는 것처럼 염소 기체가 들어있는 플라스크에 금속 나트륨을 넣어주면 둘 사이에 격렬하게 반응이 일어나 염화나트륨이 생성된다. 이 반응에서 나트륨은 전자를 잃음으로써 양이온이 되고 염소는 전자를 얻어 Cl- 음이온이 된다. 그리고 이 두 이온은 서로 반대 전하를 가지고 있기 때문에 강한 정전기적 인력으로 결합하여 소금 결정이 형성된다. 나트륨 원자는 전자를 하나 잃으려는 경향이 있고 염소 원자는 전자를 하나 얻으려는 경향이 있기 때문에 두 원소가 반응을 할 때는 그림 3에서 보는 것처럼 일대일로 반응한다.
이와 동일한 원리로 1A, 2A, 3A 족에 있는 원소들은 각각 +1, +2, +3의 전하를 가지려는 경향이 있고 반면에 5A, 6A, 7A 족의 원소들은 각각 -3, -2, -1의 전하를 가지려는 경향을 갖는다. 가운데 있는 전이금속과 주기율표 아랫부분에 있는 일부 주족 금속 원소들은 이 규칙을 따르지 않고 두 종류의 이상의 전하를 가지기도 한다. 그림 2에 각 원소들이 가질 수 있는 전하가 정리되어 있다. 팔전자 규칙을 따르는 원소들의 경우에는 그 원소가 몇 족에 소속되었는지 알면 이온결합을 어떻게 형성할 지 예측할 수 있다.
예를 들어 마그네슘(Mg)과 염소가 결합하여 이온결합 화합물을 만들 때 화학식을 결정해 보자. 마그네슘은 +2의 전하를 가지려는 경향이 있고 염소는 -1의 전하를 가지려는 경향이 있기 때문에 두 원소가 전자를 주고받아 반응하려면 마그네슘 원자 하나와 염소 원자 두 개가 결합해야 한다. 따라서 화학식은 MgCl2가 된다(그림 3). 나트륨과 황이 이온결합을 형성하는 다른 예를 살펴보자. 여기에서는 나트륨이 전자를 하나 잃고 황은 전자를 두 개 얻어야 하기 때문에 나트륨 두 개가 한 개의 황과 결합하여 화학식은 Na2S가 된다(그림 3).
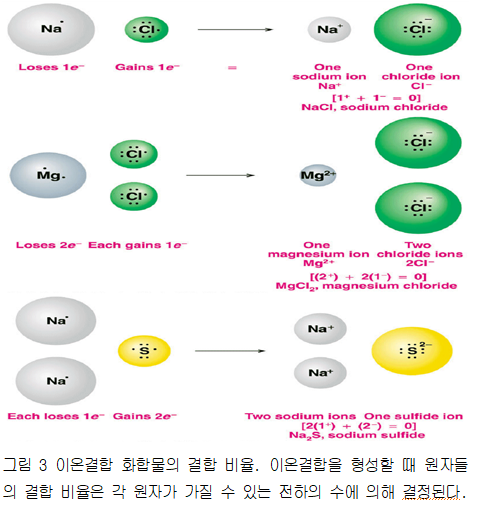
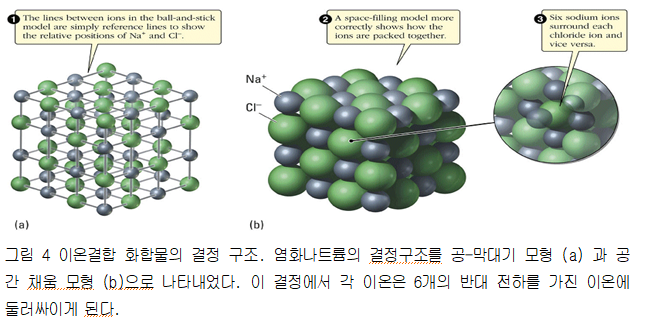
마지막으로 이온결합 화합물의 화학식은 단지 두 이온이 결합하는 비를 나타내는 것임을 기억하자. 즉 NaCl은 나트륨 이온과 염소 이온이 쌍을 이루어 독립적으로 존재하는 화합물이 아니라 여러 개의 Na+ 이온과 Cl- 이온이 일대일의 비율로 모여 있는 화합물이다. 고체 상태의 염화나트륨에서는 여러 개의 이온이 교대로 쌓여 있는 결정을 이루고 있다.
그림 4에서 보는 것처럼 각 나트륨 이온은 여섯 개의 염소 이온에 둘러싸여 있고 마찬가지로 각 염소 이온은 여섯 개의 나트륨 이온에 둘러싸여 있다. 여기에서 결정을 이루는 기본 입자는 NaCl이 아니라 이온들 즉 나트륨 이온과 염소 이온이기 때문에 결정의 모든 입자들은 이온결합에 의해 붙잡혀 있음을 명심해야 한다. 이온결합 화합물들의 녹는점이 매우 높은 이유는 바로 이것 때문이다.
[Chemistry/일반화학] - 일반화학개론 | 화학을 시작하기 전에
[Chemistry/일반화학] - 일반화학개론 | 원자의 구조와 주기성
[Chemistry/일반화학] - 일반화학개론 | 몰의 개념과 농도
[Chemistry/일반화학] - 일반화학개론 | 여러가지 화합물
[Chemistry/일반화학] - 일반화학개론 | 화학 반응과 화학 양론
[일반화학개론]화학결합과 분자구조 레포트
1. 팔전자 규칙 우리는 원자의 구조에서 원소들의 화학적 성질이 주기적으로 변하는 이유가 바로 전자배치가 주기적으로 변하기 때문이라는 것을 배웠다. 예를 들어 알칼리 금속으로 알려진 1A
www.happycampus.com


댓글