화합물들은 크게 유기화합물, 금속화합물 그리고 고분자화합물들로 분류할 수 있다. 유기화합물들은 탄소를 주축으로 하는 화합물이고 금속화합물들은 금속을 가지고 만든 화합물이다. 고분자 화합물들은 단순하게 원자가 결합되어있는 분자가 아니라 수천, 수만의 분자가 서로 연결된 화합물을 뜻한다. 그러나 최근의 화합물들은 유기분자에 금속이 치환되어 있는 유기금속화합물들이 중요한 부분을 차지하며 화합물들 간의 경계가 모호한 경우가 많아졌다. 이 장에서는 화합물들 간의 종류와 특성을 알아보고자 한다.
1 유기화합물
유기화합물은 탄소(원자번호6)원소가 기본적인 물질로 되어있으며, 탄소원자는 공유결합에 의하여 탄소원자들 끼리 몇 개라도 결합할 수 있다. 그리고 수소, 산소, 질소, 황이나 그 밖의 원자와도 결합하여 아주 다양한 화합물 분자를 만들 수 있다. 유기라는 말은 오래 전 유기화학이 살아있는 유기체로부터만 얻어 진다고 생각하여 붙여진 말이었으나, 1828년 Frederick Wohler가 포유동물의 오줌에서 배설되는 urine(유기화합물)을 ammonium cyanate로부터 합성한 뒤 그 의미는 퇴색되었다.
NH4CNO → (NH3)2CO
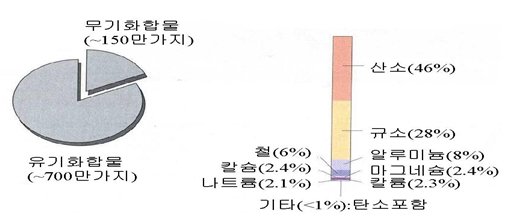
유기화합물중의 탄소는 탄소-탄소결합을 안정되게 계속할 수 있는 특성 때문에 다양하고 많은 유기화합물을 합성할 수 있다. 유기화합물은 탄소와 수소가 주를 이루고 산소와 질소 그리고 황과 인, 할로겐 원소들을 포함한다. 탄소는 112가지 원소중의 하나이지만 전체 화합물의 80%를 차지하고 있다. 약 700만 가지의 유기화합물이 현재까지 알려져 있다, 반면에 무기화합물은 150만 가지가 알려져 있다.
1-1 탄소의 특징
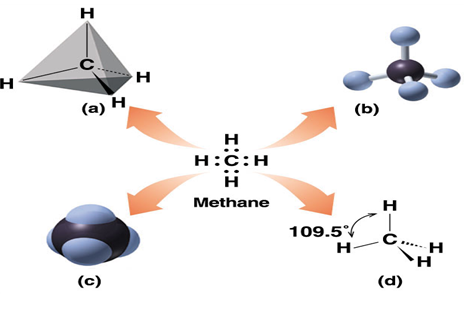
탄소는 4개의 원자가전자를 가지고 있으므로 탄소의 원자가껍질에는 전자가 반이 채워져 있다. 탄소원자는 원자가전자를 모두 잃어서 C+4가 되거나 4개의 전자를 모두 얻어서 C-4로 되지 않는다. 주기율표의 중앙에 위치하고 있으므로 탄소는 강한 전기양성도 그리고 전기음성도 아니다. 대신에 탄소는 다른 원자와 전자를 공유함으로써 공유결합을 형성한다. 예를 들면 탄소는 1개의 원자가전자가 있는 수소원자 4개와 전자쌍을 공유함으로써 결합하며 이때 만들어진 물질은 메탄(methane)이다.
원자들은 전자쌍을 공유함으로써 그들의 원자가껍질을 채우게 된다. 위의 두 가지 예에서 보는 바와 같이 탄소는 그 주위에 8개의 원자가전자를 가지게 된다. 메탄의 수소원자는 첫 번째 원자가 껍질이 2개의 전자로 채워지고 사염화탄소의 염소원자는 3번째 원자가껍질이 8개의 전자로 채워진다. 이 공유전자쌍을 공유결합(covalent bond)라고 한다. 이 결합은 전자쌍과 각 원자핵과의 인력에 의하여 원자들이 서로 결합되어 있다. 단일결합은 위의 메탄과 사염화탄소의 식에서 보는 바와 같이 흔히 선으로 나타낸다.
1-2 탄소화합물의 분류
탄소화합물은 크게 탄화수소와 탄화수소 유도체로 나누어진다. 탄화수소는 탄소화합물 중 단지 탄소와 수소로만 구성된 화합물을 의미하며 탄화수소 유도체는 탄화수소의 수소원자가 다른 원자나 원자단으로 치환된 화합물을 의미한다.
탄화수소는 다음의 세 가지로 분류할 수 있다. 첫째로 사슬모양 탄화수소와 고리모양탄화수소로 분류하는 방법과 둘째, 포화탄화수소와 불포화 탄화수소로 분류하는 방법, 셋째, 지방족 탄화수소와 방향족 탄화수소로 분류하는 방법이다.
탄화수소 유도체의 성질은 탄화수소의 수소원자대신 치환된 다른 원자나 원자단에 의해 결정되는데, 탄화수소 유도체의 공통적인 성질을 나타내는 이러한 원자단을 작용기라고 한다, 즉 탄화수소 유도체는 어떤 작용기를 가지고 있는가에 따라 성질이 결정된다.
1-3 작용기의 종류와 성질
탄소와 수소 이외의 다른 원조를 함유하는 모든 유기 분자들은 탄화수소로부터 유도된 부분과 작용기(functional group)라고 하는 또 다른 부분 (또는 부분들)으로 구성된다고 볼 수 있다. 여기서 작용기란 한 분자의 탄화수소 부분의 본성과는 관계없이 그 분자에게 특정의 화학적 성질을 부여하는 원자 또는 몇 개의 원자들의 집단이다. 따라서 이중 및 삼중결합은 탄화수소화합물 안에 있더라도 역시 작용기로 포함된다. 화합물들은 그것들의 작용기에 따라서 분류된다.
왜냐하면 하나의 특정 작용기를 포함한 모든 분자들은 그 작용기의 특유한 성질을 지니기 때문이다. 비록 단일분자 내에 2개 이상 다른 작용기가 있더라도 각각의 작용기는 다른 작용기와는 어느 전도 독립적으로 자체특성에 따라 반응하려는 경향이 있다. 표 4.1에 몇 가지 중요한 작용기를 실었다. 작용기를 함유하는 분자들은 표에서 보는 봐와 같이 특유의 어미를 가진 이름을 쓰는 IUPAC체계에 따라 명명된다. 한 분자의 탄화수소부분에 대한 화학은 그 모체 탄화수소의 화학으로부터 예측되며 그 분자의 탄화수소 부분을 보통 R로 표시한다. 만약 R이 포화탄화수소(alkane)로부터 유도된 것이면 그것을 알킬(alkyl)이라 하고 그것이 방향족 탄화수소로부터 유도된 것이면 아릴(aryl)이라고 한다.
각계열의 화합물들에 있어서 처음 몇 개는 일반적으로 가장 잘 알려져 있다. 이들 화합물의 대부분은 현재의 명명법에 따른 이름보다는 오래된 관용명으로 더 널리 알려져 있다. 화학자들은 H2O에 대하여 산화이수소라고 부르는 대신 물이라고 부르는 것과 같이 이들 화합물에 대해서는 관용명을 그래도 쓰는 경향이 있다.
작용기를 함유하는 화합물의 계통적인 이름은 반드시 탄소원자들의 가장 긴 사슬을 기준으로 할 필요는 없다. 표 4.1에서처럼 어미(즉 alkene, alkyne, alcohol 및 기타)가 가리키는 작용기를 갖는 분자에 있어서 그 이름은 그 작용기를 포함한 연속된 가장 긴 사슬을 기준으로 명명한다. 사슬에 번호를 매길 때는 그 작용기나 또는 다중 결합의 자리번호가 가장 작은 숫자가 되도록 한다. 또한 다중결합의 자리번호는 탄소-탄소 결합을 하는 2개의 탄소원자 중에서 번호가 작은 것으로 나타낸다.
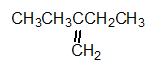
예를 들면 이 화합물은 연속된 사슬에 5개의 탄소원자를 갖는다. 그러나 그 이름은 이중결합을 갖는 4개의 탄소사슬을 기준으로 명명된다. 따라서 이름은 2-에틸-1-부텐(2-ethyl-1-butene)이다. 클로로탄화수소(chloro hydrocarbons)와 같이 접두사로 표시되는 작용기를 갖는 분자들은 그 분자에서 연속된 가장 긴 사슬을 기준으로 명명한다.
한 분자에 있는 하나의 작용기가 1차, 2차 또는 3차 탄소원자에 붙어 있는지 아닌지를 유의해야 한다. 왜냐하면 그 화합물의 화학반응성은 그 작용기의 위치에 따라 달라지기 때문이다.

[Chemistry/일반화학] - 일반화학개론 | 화학을 시작하기 전에
[Chemistry/일반화학] - 일반화학개론 | 원자의 구조와 주기성
[Chemistry/일반화학] - 일반화학개론 | 화학결합과 분자구조
[Chemistry/일반화학] - 일반화학개론 | 몰의 개념과 농도
[Chemistry/일반화학] - 일반화학개론 | 화학 반응과 화학 양론
[일반화학]여러가지 화합물 레포트
화합물들은 크게 유기화합물, 금속화합물 그리고 고분자화합물들로 분류할 수 있다. 유기화합물들은 탄소를 주축으로 하는 화합물이고 금속화합물들은 금속을 가지고 만든 화합물이다. 고분자 화합물들은 단순하게 원자가 결합되어있는 분자가 아니라 수천, 수만의 분자가 서로 연결된 화합물을 뜻한다. 그러나 최근의 화합물들은 유기분자에 금속이 치환되어 있는 유기금속화합물들이 중요한 부분을 차지하며 화합물들 간의 경계가 모호한 경우가 많아졌다. 이 장에서는 화합물들 간의
www.happycampus.com


댓글