매주마다 토끼에게 Salmonella균을 주입하고 ELISA라는 실험방법을 통해 Salmonella균에 대한 생성된 항체의 양을 측정하는 것이다.
ELISA (enzyme-linked immunosorbent assay)의 원리 및 응용
효소의 작용으로 면역글로불린의 존재를 확인할 수 있는데 이러한 효소를 표식자로 하여 항원-항체반응을 이용한 항원 또는 항체량 측정 방법을 ELISA라고 한다. 이 면역학적 검사방법은 항체 분자에 효소를 공유결합으로 부착시켜 높은 특이성과 민감도를 가지기 때문에 정성 및 정량분석에 유리하며 임상적으로 널리 쓰이고 있다.(0.001-0.01μg/㎖까지 측정가능) 이 기법은 효소의 촉매작용과 항체의 특이성에 변화를 주지 않고 효소를 공유결합시킨 항체를 사용한다.
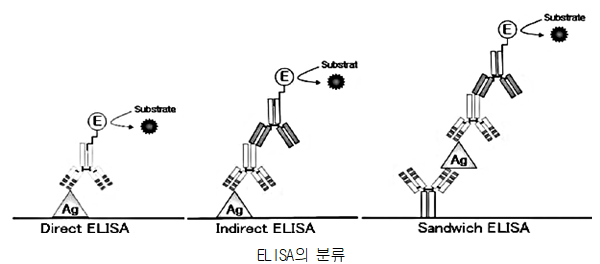
전형적인 결합효소로는 Horseradish peroxidase(과산화효소), Alkaline phosphatase, β-galactosidase를 사용하는데 이들 모두는 반응생성물이 색깔을 나타내어서 매우 적은 양으로도 측정될 수 있는 반응을 촉매한다. ELISA(enzyme-linked immunosorbent assay)에는 세 가지 기본적인 방법이 있다. 첫 번째로는 항원을 검출하는 Direct ELISA이고 두 번째는 Indirect ELISA이고 마지막으로 Competitive ELISA이다.
1) Direct ELISA (항원의 정량, 정성에 이용)
고체표면에 고정된 항원에 효소와 연결된 항체(Enzyme-linked Antibody)가 결합하면 효소가 기질의 반응을 촉매함으로써 신호를 생성하게 된다. Direct ELISA에는 가장 널리 사용되는 형태인 Sandwich ELISA도 포함이 된다. Sandwich ELISA는 검출하려는 하나의 항원에 대하여, 인식부위(epitope)가 다른 2종의 항체를 사용하는 것이며, 검출하고자 하는 항원에 대한 높은 선택성을 나타내어 진단용으로도 많이 사용이 되고 있다. 하지만 이 방법을 사용하는 많은 사람들이 점점 더 높은 검출감도를 요구하고 있으며 이를 만족시키고자 많은 연구가 진행되고 있다.
2) Indirect ELISA
1차로 주항체(Primary antibody)가 항원에 특이적인 결합을 하고, 2차로 효소가 연결된 보조항체(Secondary antibody)가 주항체를 인식하여 결합한다. 이 상태에서 보조항체에 연결되어 있는 효소가 기질의 반응을 촉매하여 신호를 내게 된다.
3) Competitive ELISA (항체의 정량, 정성에 이용)
항체의 같은 결합 부위에 대한 2가지 항원간의 경쟁에 의해 이루어진다. 2가지 항원 중 하나는 동위원소나 효소에 의해 표지된 항원이며 다른 하나는 표지되지 않은 것이다. Competitive ELISA는 표지된 항원, 표준 곡선(standard curve)을 만들기 위한 비표지된 항원(정량하고자 하는 항원), 항원에 특이적으로 결합하는 단일클론항체(혹은 항혈청) 및 항원을 포함하는 시료가 준비되어야 한다. 시료에 포함되어 있는 비표지된 항원과 항체의 반응에 따라 반응 결합물에서 약한 표지 신호가 검출되는 원리이며 표준 곡선에 의해 미지 시료 속에 포함된 항원을 정량할 수 있다. 경쟁 원리에 따라 항체의 자유로운 결합 부위가 반응용액 내에서 ‘제한 요인(limiting factor)’이 된다.
ELISA의 첫 번째 단계는 항체 혹은 항원을 고체상에 결합시키는 ‘코팅(coating)’이라는 과정이다. 대체로 96-well microtiter 플레이트가 고체상 재료로 이용된다. 항체나 항원의 흡착(adsorption)이 일반적인 코팅 방법이다. 폴리스티렌 재질의 microtiter 플레이트는 유난히 단백질이 잘 부착한다. 이러한 단백질 결합은 소수성 결합이며 대부분의 경우에 PBS(Ph7.4)나 sodium carbonate 완충용액(pH9.6)을 용매로 사용한다. 실험자가 항체나 항원의 안정성을 위해 사용할 코팅 완충용액을 결정해야한다. 또한 분석에 요구되는 코팅할 적당한 항체 혹은 항원의 농도를 0.5-10.0μg/㎖의 범위 내에서 실험적으로 결정해야 한다.
더 높은 농도를 이용하면 불안정한 2중 혹은 다중 항체 혹은 항원 층이 형성되어 역효과가 나타난다. 코팅은 대체로 96-well 플레이트의 한 well당 항체 혹은 항원을 포함하는 코팅 완충용액을 50-200㎕를 첨가한 후 2-8℃에서 밤새(10~18시간) 반응시킨다. 실험 중 여러 번의 세척 과정 동안에 항원-항체 복합체가 손실되는 것을 피하기 위해서 항체 혹은 항원을 광화학반응에 의해 활성화된 폴리스티렌 microtiter 플레이트에 공유결합시켜 코팅하는 방법도 있는데, 이 방법은 carbonate-bicarbonate완충용액(pH9.6)내에서 45분 만에 코팅이 가능하므로 시간을 절약할 수 있다는 장점이 있다.
비특이적으로 흡착된 효소-표지 항체 혹은 항원 분자에 의해 생성되는 이면 활성도(background activity)는 ELISA정량법에 문제를 야기시킨다. 따라서 자유 단백질 결합 부위의 블로킹은 이면 활성도를 최소화하기 위해 반드시 필요한 단계이다. BSA, FCS, 카제인, 젤라틴 등이 블로킹에 이용된다. 그 중 경제적인 방법은 마켓에서 흔히 구할 수 잇는 분유이다. 10Mm PBS – 0.5-5% BSA가 전통적인 블로킹 시약으로 종종 이용된다. Tween 20, Nonidet P-40, Triton X-100과 같은 비이온성 세제를 0.01-0.1%의 농도로 표지항체 혹은 항원과 반응 시 첨가하면 특이적인 항원-항체 결합은 방해하지 않으면서 고체상에 대한 비특이적인 흡착을 감소시킬 수 있다.
각각의 반응 단계 사이에 행하는 세척은 훌륭한 표준 곡선과 만족할만한 ELISA결과를 얻기위해 필수적이다. 세척 단계에서 PBS, saline, PBS-세제, 수돗물 등을 이용할 수 있다. 보편적인 세척 완충용액은 PBS/0.05% Tween 20이다. ELISA에 이용되는 효소에는 소의 혈청으로부터 추출한 Horseradish peroxidase(HRP)와 alkaline phosphatase(AP), Escherichia coli로부터 추출한 β-galactosidase, Aspergillus niger로부터 추출한 glucose oxidase등이 있다.

효소 활성도는 색변화(colormetric-), 형광(fluorimetric-) 혹은 발광(luminometric-) 검출성 기질에 의해 검출될 수 있다. 색변화를 보이는 기질이 널리 이용되며 다음과 같은 장점이 있다. 첫 번째 반응이 멈추어도 색깔을 띠는 최종 산물이 오랜 시간 동안 안정적으로 유지될 수 있다. 두 번째 선별 과정 중, microtitier 플레이트를 빠르게 시간적으로 감지할 수 있다. 마지막으로 상대적으로 값싼 광도계로 빠르게 산물을 측정할 수 있다.
형광 및 발광-검출성 기질을 이용하여 측정하면 민감도를 대략 2-10배 증가시킬 수 있지만 측정 장비가 비싸고 최종 반응물이 빨리 사라진다. 그러나 측정할 수 있는 시료가 제한되어 있는 경우에는 형광-검출성 기질을 이용하면 검출 시 시작 용액 부피를 감소시킬 수 있기 때문에 유용하다. 만약 민감도가 특히 중요한 정량법이라면 효소는 HRP, 기질은 형광-검출성 기질인 HPPA 혹은 색변화-검출성 기질인 TMB를 이용할 수 있다.
실험 방법
1. Polyclonal Antibody의 제조
토끼에게 대조군으로 사용할 피를 먼저 뽑는다. 그리고 난 후에 Salmonella균과 Freund's complement adjuvant를 첫 주에 넣어준다. 이 adjuvant의 역할은 HOST의 면역체계를 자극하여 면역반응을 증가시키는 것이다. 이 때 토끼에 주입할 때 각각 0.5㎖씩 넣어준다. 그리고 두 번째 주부터는 Freund's incomplement adjuvant를 넣어주는 데 첫 째주에 넣어준 complement와 차이가 있다. 그 차이는 마이코박테리아의 유무인데 마이코박테리아가 없는 incomplement의 경우에, 항원이 면역담당 세포에 노출되는 시간을 연장함으로써 효과를 얻는다고 한다.
그리고 이렇게 Salmonella균과 adjuvant를 투여하고 1주일이 지난 후에 채혈을 한다. 이 채혈한 혈액을 원심분리시키면 혈병과 혈청으로 나누어지는 데 여기서 상층액인 혈청을 항혈청이라 하고, 이 항혈청 속에는 Salmonella 균에 대한 항체가 들어있다. 이렇게 첫 번째는 단계는 끝났다. 다음 단계는 이렇게 생성된 항체를 ELISA를 이용하여 생성된 정도를 알아보는 것이다.
2. ELISA를 이용한 항체의 생성된 정도를 측정
① 먼저 96-well plate의 각 well에 최종농도가 0.5μg/㎖가 되도록 PBS로 희석한 antigen을 90㎕씩 넣고 Filter paper 위에 plate를 올려놓고 wrap으로 싸서 37℃에서 incubator에 넣어 2시간동안 배양한다. 그리고 aspiration하거나 plate를 털어서 antigen 용액을 제거한다.
② 다음엔 Tween-20을 0.05% 포함하는 PBS를 200㎖씩 방울방울 떨어뜨려 well에 넣은 후 역시 빨아내거나 털어낸다. 여기서 Tween-20은 계면활성제로 washing을 위해 사용된다. 그리고 PBS(Tween-20 0.05%포함됨)에 녹인 1% skim milk를 90㎕씩 각 well에 한 방울씩 떨어뜨려 넣고 2번 과정과 같이 1시간 동안 배양한다.
③ 이러한 washing과정을 2번 반복한 후에 primary antibody soultion을 82.5㎕씩 각 well에 방울방울 떨어뜨려 넣는다. 그리고 섭씨 37도 incubator에서 1시간~1시간 반을 두고 또 washing을 3번 더 한다.
④ 다음 차례는secondary antibody solution을 75㎕씩 각 well에 넣고 37℃의 incubator에 1시간~1시간 반 둔다. 또 washing을 3번 한다.
⑤ Alkaline phosphatase substrate solution (1㎎/㎖)을 70㎖씩 넣고 37℃ 또는 상온에서 30분간 반응시킨다. 마지막으로 ELISA reader로 405㎚에서 흡광도를 측정한다.
[Biology/생명과학 & 생명공학] - 생명과학실험 | Enzyme-linked immunosorbent assay
[Biology/유전학 & 면역학] - 면역학실험 | Rabbit의 면역체계를 이용한 항원-항체 반응 - Rabbit 체내의 Salmonella 균에 대한 항원-항체 반응
[Biology/유전학 & 면역학] - 면역학실험 | ELISA (Enzyme Linked Immunosorbent assay)
[Biology/유전학 & 면역학] - 면역학실험 | Mouse immune system의 면역반응 test와 해부학적 구조 확인
[Biology/유전학 & 면역학] - 면역학개론 | Enzyme-Linked Immunosorbent Assay(ELISA)
[면역학실험]ELISA를 이용한 토끼에서 살모넬라균의 항체 검출 레포트
1. 실험 목적 매주마다 토끼에게 Salmonella균을 주입하고 ELISA라는 실험방법을 통해 Salmonella균에 대한 생성된 항체의 양을 측정하는 것이다. 2. 실험 이론 및 원리 살모넬라균 장내세균과에 속하며 사람과 동물에 병원성을 나타내어 티푸스증이나 급성위장염, 식중독 등을 일으키는 세균이다. 살모넬라에는 균체항원(O항원)과 편모항원(H항원)에 수십 종류가 있고, 또한 Vi항원이 가해져서 이들 항원의 조합으로 항원을 달리하는 2,000 이상의
www.happycampus.com


댓글