
1. PTM(post-translational modifications)의 의미와 N-linked 와 O-linked glycosylation의 차이를 알 수 있다.
2. 균주 Hansenula polymorpha를 YPM배지에서 배양한 후, TCA down을 통해 세포외 단백질을 농축하여 얻고 cell lysis를 통해 세포내 GOD 단백질을 얻고 OD값 측정으로 단백질 정량을 할 수 있다.
3. SDS-PAGE의 방법과 원리를 이해하고 만들어 Western blotting을 통해 GOD 단백질의 발현 여부와 그 크기를 알 수 있다.
SDS-Page
Acrylamide를 가교제 (cross-linker)로 중합한 polyacrylamide gel은 acrylamide와 가교제의 농도 및 비율에 의해 gel내 미세통로의 크기를 조절할 수 있어 다양한 크기의 생체 분자들을 분리할 수 있을 뿐만 아니라 높은 정밀도와 고분해능으로 인해 오래 전부터 단백질, 핵산 등의 분리에 널리 사용돼 왔다. Polyacrylamide gel은 acrylamide 측쇄 기능기가 N,N'-methylene bisacrylamide와 같은 2개의 기능기를 가지는 화합물에 의해 비가역적으로 중합되어 형성된 polymer이다.
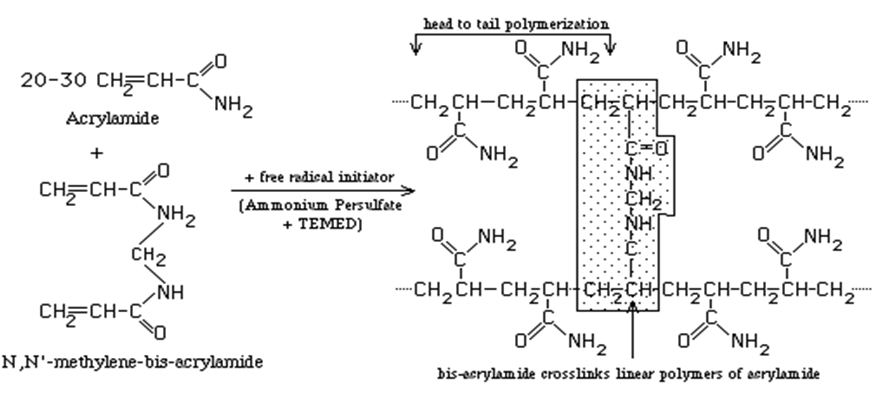
가교제로는 N,N'-methylene bisacrylamide이 (일반적으로 bisacrylamide라 한다) 많이 사용되고 있으며, 또는 N,N'-bisacrylylcystamine (BAC), N,N'-diallyltartardiamine (DATD), Ethylene diacrylate (EDIA) 등도 특수한 목적으로 사용되기도 한다. 생체물질의 효과적인 분리 범위는 polyacrylamide의 농도와 가교제와의 중합 정도에 의해 결정되며 가교제에 의해 중합되어 생긴 gel은 적절한 강도와 탄성을 유지하고 polypeptide가 통과할 작은 구멍을 형성한다.
이 구멍의 크기는 가교제와 polyacrylamide의 비율이 증가할수록 감소하여 약 1:20 정도에서 가장 작게 된다. 대부분의 polyacrylamide gel은 1:29의 몰 비율로 제조하며 사용하고 있으며 이 비에서 분자량이 3% 정도의 차이가 있는 polypeptide를 분리할 수 있다. Polyacrylamide gel은 %T와 %C로 표현되는데 %T는 acrylamide와 bisacrylamide의 %중량이며 %C는 가교제인 bisacrylamide의 %중량이다. 따라서 %T와 %C가 커지면 그만큼 미세통로의 크기는 작아지게 되어 작은 물질의 분리에 이용할 수 있게 된다.
Polyacrylamide gel을 사용하는 단백질 전기영동법은 크게 두 가지로 나눌 수 있는데 하나의 gel만을 사용하는 연속적 시스템(continuous buffer system)과 buffer조성이 다른 두 개의 겔을 사용하는 불연속적 방법이다 (discontinuous buffer system). 연속 시스템은 pH 3-11 사이의 완충용액을 한가지 선택하여 겔과 음전극액 내 전해질 조성 및 농도를 동일하게 만들어 전기영동하는 방법이고 불연속 시스템은 흔히 우리가 알고 있는 stacking gel을 사용하는 경우이다. 또한 단백질 전기영동법은 ionic detergent의 사용유무에 따라 dissociating 또는 non-dissociating 법으로 구분하기도 한다.
Dissociating법은 sodium dodecyl sulfate (SDS)와 같은 ionic detergent나 수소결합을 끊어주는 urea등을 단백질 시료에 첨가한 후 열을 가해 denature시킨 후 단백질복합체를 개별 단백질로 해리하여 분석하는 방법으로 disufide bond를 해리 시켜주는 reducing agent (b-mecaptoethanol 또는 DTT)의 사용유무에 따라 reducing 또는 non-reducing법으로 구분하기도 한다. Non-dissociating 법은 단백질변성을 주지 않고 단백질 복합체를 단백질의 고유한 전하에 의해서만 분리하는 방법이다 (흔히 Native PAGE라고 한다).
단백질 분리를 위한 전기영동에 있어서 오늘날 가장 광범위하게 쓰이고 있는 SDS-불연속 전기영동법(SDS-discontinuous polyacrylamide gel electrophoresis; SDS-PAGE)은 1970년 Laem㎖i, U.K.에 의해 개발되었다(Laem㎖i, U.K. (1970) Nature 227, 680-685). 불연속 전기영동법의 가장 큰 장점은 많은 용적의 시료를 로딩하더라도 좋은 해상도로 얻을 수 있다는데 있다. 전기영동용 완충용액(running buffer)에 포함된 glycine은 의가약산으로서 음전하와 양전하를 동시에 띨 수 있다. 이와 같은 zwitter이온의 성질을 이용하면 gel내의 pH조건에 따라 glycine의 net charge와 이로 인한 전기영동속도를 조절할 수 있다.
전기영동을 시작하면 leading 이온인 Cl-이온과 단백질, glycine이온이 모두 양극을 향해 출발하게 된다. Glycine은 stacking gel의 낮은 pH 조건에서는 거의 중성을 띠므로 국부적인 전류의 감소현상이 유발된다. 따라서 낮은 pH 조건에서도 이동도가 빠른 Cl-이온과 이동도가 느린 glycine 이온 사이에 매우 높은 전위차가 형성되는데 이러한 전위차에 위해 glycine이온이 Cl-이온을 빠르게 뒤따르게 된다. 이때 상대적인 이동속도는 glycine < 단백질 < Cl-이 되며 따라서 단백질은 Cl-와 glycine 이온사이에 축적되어 이동하게 된다.
Cl-와 glycine 이온의 간격은 수 mm로서 많은 용적의 시료에 있던 단백질도 running gel에 들어가기 전에 이 사이에 축적되어 해상도를 높이는 효과를 나타내게 된다. Stacking gel은 large-pore gel이므로 단백질의 molecular sieving현상은 나타나지 않는다 (gel내의 미세통로 크기에 따라 단백질이 분리되는 현상). 이동 중인 이온들이 running gel에 이르게 되면 running gel의 높은 pH는 glycine이온을 음전하로 강하게 대전시켜 glycine의 이동속도가 단백질보다 빠르게 되며 단백질은 gel내에서 molecular sieving현상에 의해 분리된다.
[Biology/생명과학 & 생명공학] - 생명과학실험 | Western blot analysis
[Biology/분자생물학] - 분자생물학실험 | Protein assay and Western blot
[Engineering/식품 영양 & 공학] - 영양생화학실험 | SDS-PAGE에 의한 단백질 분리와 Western Blotting
[Biology/분자생물학] - 분자생물학실험 | Western blotting
[분자생물학실험]Western blotting 레포트
1.1.1. 개요 Sodium dodecyl sulfate-polyacryamide gel electrophoresis(SDS-PAGE)는 단백질을 정제하는 동안 이를 monitor하고, 정제된 단백질의 동질성(homogeneity)을 알기 위한 가장 좋은 방법이다. SDS-PAGE는 일반적으로 단위체의 분자량을 결정하고, 정제된 단백질의 단위체 구성을 알기 위해 사용된다. SDS-PAGE는 더 깊은 연구를 위한 충분한 단백질을 얻기 위해 scale up
www.happycampus.com


댓글