
Western blot은 여러 단백질의 혼합물로부터 어떤 특정단백질을 찾아내는 기법으로서 찾고자 하는 단백질에 대한 항체를 사용하여 항원-항체 반응을 일으킴으로써 특정단백질의 존재여부를 밝혀낸다. 특정 단백질을 찾기 위해서 먼저 gel electrophoresis를 이용하여 크기별로 분리해낸다. 단백질을 순수하게 크기별로 분리해 내기 위해서는 단백질의 단위 질량당 charge와 3차원 folding 구조를 모두 같게 해줘야 한다. 이런 이유로, 단백질은 SDS-PAGE(sodium dodecyl sulfate-polyacrylamide gel electro phoresis)를 수행한다.

이는, SDS를 detergent로서 이용하여 단백질을 모두 단위 질량당 같은 정도의 negative charge를 띠게 해줘서, 각 protein간의 전하 차이를 제거하며, 동시에 folding 구조를 깨뜨려서 형태의 차이로 인한 이동 속도의 변화를 없게 해준다. 따라서 이러한 처리를 가해준 단백질은 순수하게 크기에 해당하는 정도로 - electrode로부터 + electrode를 향하여 이동하게 된다. 이렇게 단백질을 크기별로 분리해낸 후에, 단백질을 nitrocellulose 또는 nylone membrane으로 transferring 시킨다(단백질을 옮기는 이 과정을 western blot 또는 western transfer라고 한다). 이 과정에서도 역시 단백질의 전하 특성을 이용하여, - electrode 쪽에는 gel을, + electrode 쪽에는 membrane을 놓게 된다. 이렇게 하면, 크기별로 분리된 단백질이 그대로 membrane으로 이동하게 된다.
이제는 membrane 상에서 우리가 관심을 갖는 대상 단백질에 대한 항체를 이용하여 그 단백질을 찾을 수 있다. 이때 사용하는 항체는 찾고자 하는 항원(단백질)에 대해 특이하게 반응하는 것을 방사성 동위원소로 표시하여 사용하거나 또는 특정 효소(예: alkaline phosphatase, horseradish peroxidase 등) 또는 형광을 나타내는 색소(예: FITC: fluorescence isothiocyanate)를 결합시킨 것을 이용함으로서 찾고자 하는 적은 양의 단백질을 가시화할 수 있다.
1. SDS-PAGE
정량이 끝난 protein sample을 가지고 전기영동에 필요한 양을 계산하여, 전기영동한다.
2. Transfer
SDS-PAGE가 끝나 size별로 분리된 protein을 separation gel 부분만 가지고 membrane에 옮기는 과정. 이 때 사용하는 membrane은 크게 3종류가 있는데,
① nitrocellulose membrane – 경제적이다. 비특이 항체 결합에 대한 차단이 빠르고 간단하다. 단백질 결합능력 : 80㎍/㎠
② 양전하성 nylon membrane - 단백질 결합능력이 크다 : 480㎍/㎠, 분자량이 큰 단백질이나 산성단백질일 경우에 사용한다.
③ PVDF(poly-vinylidene difluoride) - 단백질 결합능력 : 140-150㎍/㎠, 구겨지지 않고 재사용이 가능하다. 소수성(Hydrophobic) 결합
실제 실험실에서는 경제성이나 protein transfer 수율을 고려하여 가장 많이 사용되는 것은 nitrocellulose membrane이다.

Transfer buffer의 조성은 39mM Glycine, Tris 48mM, SDS 0.037%, methanol 20%인데, transfer buffer에 methanol이 들어가는 이유는 SDS-protein complex의 Nitrocellulose membrane에 대한 binding capacity를 증가시키는 역할을 하기 때문이다. 그러나 methanol을 100kD 이상의 단백질을 gel에 엉겨 붙게 하는 작용도 하므로 큰 단백질을 transfer하고자 할 때는 methanol을 제외시키고 transfer buffer를 제조하기도 한다.
3. Ponceau S staining
단백질이 제대로 transfer되었는지를 확인하고 standard size marker의 위치를 표시하기 위함이다. Ponceau S staining으로 모든 단백질이 다 보인다. Ponceau S staining은 SDW에 쉽게 빠진다.
4. blocking
membrane에 전기적으로 전달된 단백질이 결합하고 있는 부분 즉, membrane의 protein -untransferred 부분을 다른 균일한 protein(ex. BSA, gelatin, non-fatdry milk)와 detergent(Tween 20, Triton S-100)등의 차단물질을 사용하여 막아버리는 것으로서 더 이상 다른 미지의 protein으로부터 membrane이 오염되는 것을 방지하는 것이다. 대부분 TBS-T buffer로 만든 5% skin milk를 이용한다.
5. 1차 Antibody
특정 protein을 detection할 경우에, 반드시 그 protein의 epitope를 하나라도 알고 있어야 그 protein의 epitope를 사용해서 antibody를 만들 수 있다. 보통 antibody를 얻는 방법으로 protein을 토끼나 쥐에 injection한 후 그 혈액을 뽑아내서 centrifuge시킨 후에, 혈청만 얻어낸다. 이 혈청 안에 있는 IgG를(대부분 혈청 그대로를) 양(goat)에 다시 주사한다. 이렇게 하면, 첫 번째 혈청 안에는 protein에 대한 1차 antibody가 형성되고, 양의 혈청 안에는 2차 antibody가 형성되어 이용할 수 있게 된다. 1차 antibody는 항원 단백질에 대한 항체가 그 (관찰하기 원하는)특정단백질에 붙는 과정으로 사용량은 실험적으로 결정하는 것이 좋으나 1/100-1/1000으로 희석해서 사용하기도 한다. 1차 antibody는 TBS-T buffer로 만든 5% skin milk와 함께 4℃에서 흔들어주면서 overnight으로 붙인다.
6. washing
antibody의 비특이적인 결합을 줄이기 위해 TBS-T buffer로 흔들어주면서 5-10min씩 3회 수행한다.
7. 2차 antibody
1차 antibody를 항원으로 인식하여 binding하는 2차 antibody는 그 끝에 기질을 분해하여 빛을 내는 enzyme이 link되어 있어서 2차 antibody를 붙인 후에 protein detection을 할 수 있다. 대부분 horse radish peroxidase(HRP)가 표지된 항체를 사용하며, 제품화되어 있다. 붙이는 방법은 1차 antibody와 동일한 방법으로 RT에서 1시간동안 붙인다.
8. washing
9. Detection
단백질(항체도 단백질..)은 그 스스로 발광하는 능력이 없기 때문에 detection하기 어렵다. 따라서 2차 antibody에 HRP라는 효소를 붙여서 이용한다. HRP는 Horse Raddish Peroxidase의 약자로써 Peroxide를 분해하는 효소이다. HRP가 Peroxide를 분해하면서 발광하여 그 빛으로 detection이 가능하다. 이러한 HRP 효소가 연결된 2차 항체를 붙인 후, 이 효소의 기질인 substrate를 뿌려주면 발색반응에 의해서 X-ray film에서 detection할 수 있다.

실험 방법
1. Western Transfer
1) Transfer 완충용액 (48mM Tris-Cl, 39mM glycine, 0.037% SDS, 20% methanol)을 제조하여 4℃정도로 차게 유지한다.
2) nitrocellulose membrane와 3MM paper 2장을 gel size에 맞게 적당한 크기로 자른 후, transfer buffer에 담가 10-30분간 평형 시킨다.
① Nitrocellulose membrane을 사용하는 경우 완충용액에 담그기 전에 증류수에 먼저 한쪽 끝부터 서서히 전체 membrane을 적신 후 완충용액에 담근다. 전기영동이 끝난 gel도 transfer buffer로 10분간 평형 시킨다.(생략한 과정)
② gel, 3MM paper, nitrocellulose membrane를 다룰 때에는 반드시 polyglove를 착용해야 한다. 손의 분비물에 의해 transfer가 방해를 받을 수도 있다.
3) Western blot용 cassette를 transfer 완충용액이 담긴 용기에 놓고 그 위에 transfer 완충용액에 적신 sponge와 Whatman 3MM 여과지 1매를 올려놓는다.
4) Transfer 완충용액으로 평형시킨 gel을 기포가 생기지 않도록 조심스럽게 Whatman 3MM 여과지 위에 올려놓는다.
5) Gel 위에 transfer 완충용액으로 평형시킨 nitrocellulose membrane을 기포가 생기지 않도록 조심스럽게 놓고 그 위에 여과지를 1매와 sponge를 올려놓는다.
6) Cassette를 기포가 생기지 않도록 조심스럽게 고정 장치한 후 양쪽 cassette가 떨어지지 않도록 clip을 조인다.
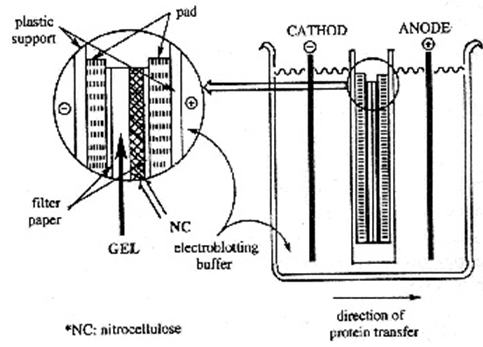
7) 장치된 cassette를 blotting chamber에 옮긴 후 cassette내의 membrane이 충분히 잠기도록 표시된 부분까지 transfer 완충용액을 넣고 membrane 쪽이 양극, gel 쪽이 음극이 되도록 전극을 장치한 다음 75V로 1시간 30분 동안 transfer한다. (4℃ transfer 권장. 그 이유는? transfer 동안 전류의 흐름으로 인해 열이 발생하고 온도가 올라가면 gel과 membrane 사이에 air bubble이 형성되어 transfer가 잘 되지 않으므로..)
① 단백질의 크기가 클수록 transfer에 필요한 시간이 길어진다. 분자량이 큰 단백질의 transfer를 위해 전압을 90V까지 증가시킬 수도 있고 transfer 시간을 길게 할 수도 있다. 또, transfer 시간을 짧게 하려면 전압을 높게 걸어주면 된다.
8) Transfer가 끝난 후 nitrocellulose membrane을 SDW에 씻은 다음, Ponceau S staining을 통해 Transfer가 어느 정도 되었는지를 확인하고 size marker의 각 band를 표시한다.
① Transfer의 최대 관건은 air bubble이 생기지 않도록 하는 것이다.
[Biology/생명과학 & 생명공학] - 생명과학실험 | Western blot analysis
[Biology/분자생물학] - 분자생물학실험 | Western blotting
[Biology/분자생물학] - 분자생물학실험 | Protein assay and Western blot
[Engineering/식품 영양 & 공학] - 영양생화학실험 | SDS-PAGE에 의한 단백질 분리와 Western Blotting


댓글