
족과 주기
주기율표에서 같은 행(가로줄)에 있는 모든 원소들은 같은 주기(period)에 속한다. 주기는 모든 7개가 있는데 첫 번째의 1주기는 2개의 원소로만 구성되어 있다. 2주기와 3주기에는 각각 8개의 원소가 있고 그 다음 4와 5주기에는 각각 18개의 원소가 있다. 6주기에는 32개의 원소가 있다. 또 마지막의 7주기는 아직 완성하지 못한 상태이다(그림 1, 2 참조).
주기율표에서 같은 세로 열에 있는 원소들은 같은 족(group 또는 family)에 속한다. 이들은 유사한 화학적 성질을 가지며 위에서 하나씩 아래로 내려감에 따라 그 성질이 점차 변한다.
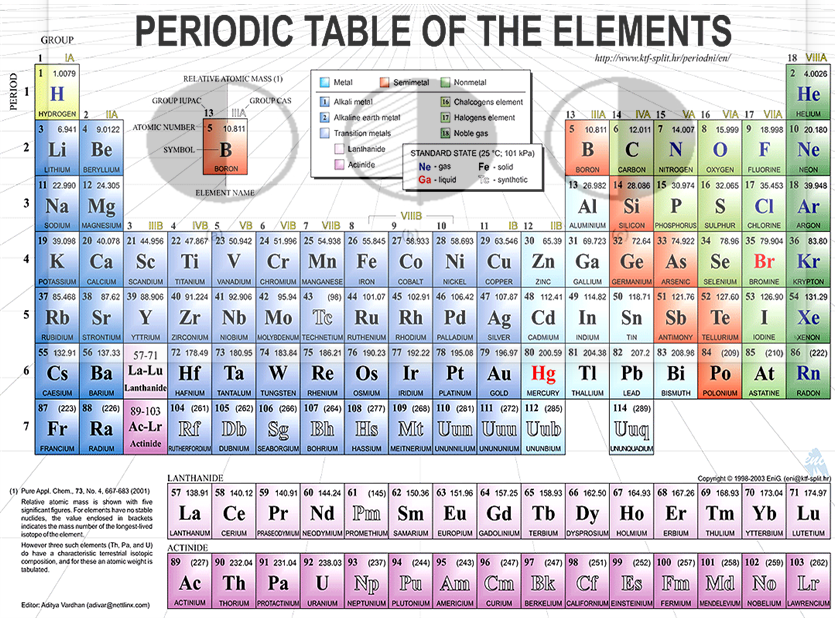
알칼리 금속(alkali metal)들은 수소를 제외한 ⅠA족 원소들이고, 알칼리 토금속(alkali earth metal)들은 ⅡA족 원소들이다. 그리고 주조금속(coinage metal)들은 ⅠB족 원소들이다. 할로겐(halogen)들은 ⅦA족의 원소들이고 불활성기체(inert gas)들은 0족 원소들이다.

주족원소와 전이원소
[그림 3]은 주기율표에서 원소들을 분류하는 또 다른 방법을 보여주고 있다. 즉 주기율표를 주족원소(main group element), 전이원소(transition element) 그리고 내부전이원소(inner transition element)들의 세 영역으로 나누어 분류한다. 전이원소들에는 철이나 구리같이 일상생활에서 중요하게 쓰이는 원소들이 포함된다. 두 내부전이원소 계열은 6주기의 란탄(La)과 7주기의 악티늄(Ac)으로부터 시작하는 원소들로 이루어져 있다.

첫 번째 내부전이원소 계열은 란탄에서 시작되기 때문에 란탄 계열(lanthanide series)이라 하고 두 번째 내부전이원소 계열은 악티늄에서 시작되기 때문에 악티늄 계열(actinide series)이라고 한다. 내부전이원소에는 우라늄이나 플루토늄과 같은 중요한 원소들이 포함되어 있다. 우라늄 오른쪽에 있는 모든 악티늄계 원소들은 자연상태로 존재하지 않는다. 이들은 전부 인공적으로 만들어졌고 방사성을 나타낸다.
금속원소와 비금속원소
원소들은 성질의 차이에 의하여 금속과 비금속으로 분류된다. 금속원소들은 일반적으로 금속 광채를 띠고 두드려서 얇게 펼 수 있는 전성(mallea- bility)이 있으며, 길게 늘려 가는 선으로 만들 수 있는 연성(ductile)을 갖는다. 그러나 비금속원소들은 전성과 연성을 갖지 않고 부스러지기 쉽다. 또 금속원소들은 전기를 통하지만 대부분의 비금속원소들은 그렇지 못하다.
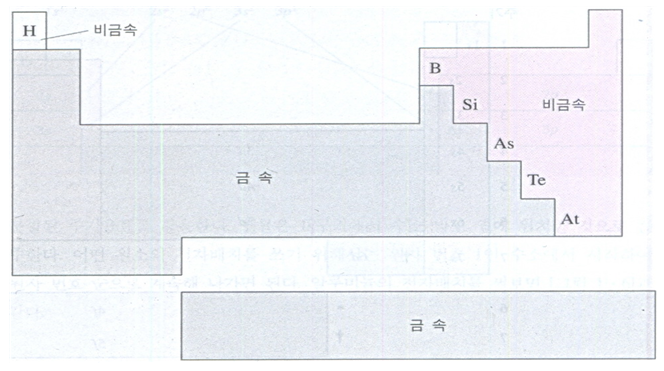
주기율표에서 금속(metal)원소들은 붕소(B)의 왼쪽에서 시작하여 아래쪽 아스타틴(At)에 이르기까지 계단식 경계선의 왼쪽에 위치한다(그림 1-4 참조). 수소를 제외한 모든 비금속(nonmetal)원소들은 이 경계선의 오른쪽에 있다. 금속원소들의 수는 비금속원소들의 수보다 훨씬 많다. 그리고 계단식 경계선 근처의 일부 원소들은 금속과 비금속의 성질을 함께 지니고 있기 때문에 준금속(metalloid)원소라고 부른다.
수소는 독특한 성질을 갖고 있다. 수소는 주기율표에서 계단식 경계선을 중심으로 금속 쪽에 위치하는데, 그 이유는 금속의 화학적 성질과 유사한 성질을 지니고 있기 때문이다. 한편 수소는 비금속의 물리적, 화학적 성질도 갖고 있기 때문에 어떤 주기율표에서는 할로겐족 위에 놓이기도 한다. 그러나 실제로 수소는 알칼리 금속도 할로겐도 아니므로 어느 위치에 놓여도 모두 어울리지는 않는다.
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[Chemistry/생활 속 화학] - 화학 이론 | 산과 염기 1부
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글