
산화와 환원
산화-환원반응(oxidation-reduction reaction ; redox reaction)은 많은 화학반응 중에서 가장 중요한 반응의 하나이다. 실제로 에너지를 얻기 위해서 이루어지는 모든 화학반응은 산화-환원 반응이다. 연료의 연소, 전지에 의한 전기의 발생, 전기분해반응 그리고 음식물의 대사 등은 산화-환원 반응이며, 그밖에 광석에서 금속을 얻는 것도 산화-환원 반응을 이용한 것이다.
아연 금속조각을 구리(Ⅱ) 이온이 함유된 푸른색 용액에 넣었을 때, 아연은 점차로 녹고 구리가 침전되면서 구리(Ⅱ) 이온의 용액은 푸른색을 잃게 된다.

이 반응에서 한 금속이 생성되는 동안에 다른 금속이 소모되기 때문에 산화와 환원이 동시에 일어나고 있음을 알 수 있다. 실제로 산화에는 반드시 환원이 따르고 반대로 환원에는 산화가 따른다. 모든 산화-환원 반응의 주요 특성은 반응물이 각각 전자를 잃고 얻는 것이다. 공유결합 물질들도 산화되고, 또 환원될 수 있다. 산화-환원 반응에서 분자 내 전자의 총수를 추적하기 위해서 산화수(oxidation number)의 개념을 도입하는 것이 편리하다.
산화수
산화수(oxidation number)는 결합극성(bond polarity)을 이루는 화합물의 구성 원자에 할당되는 단위 전하수이다. 두 성분의 이온결합 화합물에 있어서 원자의 산화수는 두 원자로부터 유도되는 이온의 전하와 같다. 예를 들면 NaCl에 있어서 나트륨과 염소의 산화수는 두 원자로부터 유도되는 이온의 전하와 같다. 따라서 나트륨의 산화수는 +1이고 염소의 산화수는 -1이다. 산화-환원을 쉽게 설명하기 위하여 다음 규칙에 따라서 분자나 착이온 내의 원자에 대한 산화수를 정한다.
① 유리된 원소의 원자에 대한 산화수는 0이다. 즉 H2, O2, Fe, Cl2에 있어서 각 원자의 산화수는 0이다.
② 화합물 상태에서 알칼리 금속(ⅠA족 원소)의 산화수는 +1이고 알칼리 토금속(ⅡA족 원소)은 +2이다.
③ 단일원자 이온의 산화수는 그 전하와 같다. 즉 Na+의 산화수는 +1이며 Ca2+는 +2 이고 Cl-는 -1이다.
④ 비이온성 화합물인 경우 수소의 산화수는 +1이다. 이 규칙은 대다수의 수소 화합물 즉, H2O, NH3, HCl, CH4 등에 적용된다. NaH와 같은 이온성 금속 수소화물에 대한 수소의 산화수는 -1이다.
⑤ 산소를 가진 대부분의 화합물에서 산소의 산화수는 -2이다. 즉 H2O, H2SO4, NO, CO2, CH3OH 등에서 산소의 산화수는 -2이다. 그러나 과산화수소, H2O2에서는 -1이고 초과산화물에서는 -1/2 산화수를 갖는다. 산소가 -2의 산화수를 갖는다는 규칙에 대한 또 다른 예외는 OF2이며 여기서 O는 +2이고 F는 -1이다.
⑥ 수소 혹은 산소를 포함하지 않는 비금속의 화합물에서는 전기음성도가 더 큰 비금속을 음으로 생각한다. 그 산화수는 흔히 보는 음이온의 전하와 같은 값으로 한다. 예컨대 CCl4에서 염소의 산화수는 -1이고 탄소는 +4이다. CH4에서 수소는 +1이고 탄소는 -4이다. SF6에서 플루오르는-1이고 황은 +6이지만 CS2에서는 S가 -2이고 C는 +4이다.
⑦ 화합물에서 모든 원자의 산화수의 대수합은 0이어야 한다. 즉 NH4Cl에서4개의 수소 원자의 산화수는 4(+1)=+4이고 Cl의 산화수는 -1이므로 N의 산화수는 -3이다.
⑧ 다원자 이온에서 모든 원자의 산화수의 대수합은 이온의 전하와 같다. 즉 NH4+에서 N의 산화수는 x+4=+1이므로 -3이다. SO42-에서 4개의 산소 원자는 총 -8의 산화수를 가지므로 황의 산화수는 이온의 전하가 -2가 되기 위해 +6이어야 한다.
⑨ 화학반응에서 총 산화수는 보존된다. 산화수가 현대 화학에서 유용한 것은 이 때문이다.
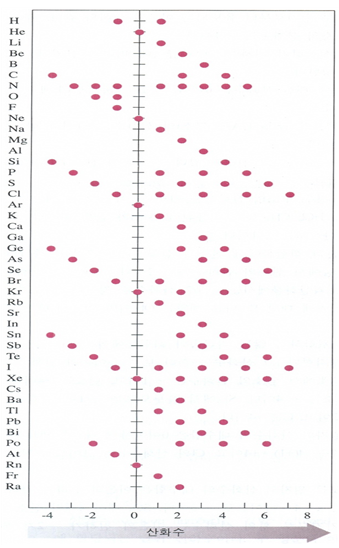
반응 중에 한 원자의 산화수가 증가하면 그 원자는 산화(oxidation)되었다고 하고 감소하면 환원(reduction)되었다고 한다. 계수를 맞춘 화학반응식에서 산화와 환원은 서로 정확히 상쇄되어야 한다. 앞의 규칙으로부터 대개의 분자나 착이온을 만들고 있는 원자의 산화수를 계산할 수 있다. 어떤 산화수는 원소에 따라 특색이 있으며 주기율표에서 원소의 위치와 관련지을 수 있다. [그림 1]은 산화수가 원자번호에 따라 어떻게 변하는가를 보여준다. 일반적으로 최대 산화수는 한 주기 내에서 +1에서 +7까지 증가된다.
주기율표에서 ⅠA~ⅢA 족에 속하는 주족금속 원소는 그 족의 번호와 같은 양전하를 갖는 이온을 만든다. 즉 산화수는 그 족의 번호와 같다. 비금속 원소들의 최소 산화수는 보통-(8-족의 번호)이며, 각 원자는 (8-족의 번호)개의 수소 원자와 결합한다. 예를 들면 황 원자(ⅥA족)는 산화수가 -2이므로 2개의 수소 원자와 결합한다(표 1 참조).

전이금속계열에서 앞의 원소들은 최대 산화수가 족 번호와 같이 +7까지 증가한다. 이것은 MnO4-에서 Mn의 산화수와 같다. 이후부터는 최대 산화수가 다시 감소하기 시작해 [표 2]과 같이 아래쪽으로 한자리씩 옮김에 따라 산화수가 하나씩 감소한다.
내부 전이금속인 란탄족과 악티늄족 원소는 또 다른 형의 전이계열이며 이것들은 서로 비슷한 성질을 갖는다. 란탄족과 악티늄족 화합물에서 이들은 대체로 +3의 산화수를 갖는다. 다른 산화수도 있을 수 있는데 흔한 산화상태는 Eu2+, Ce4+, U6+ 등이 있다.

상대적인 산화-환원 경향
산화-환원 반쪽반응은 다음과 같은 관계가 성립한다.

위의 식에서 산화형과 환원형을 산화-환원형(redox couple)이라고 한다. 적당한 산화제를 가하면 환원형을 산화형으로 산화시킬 수 있다. 반대로 적당한 환원제를 산화형에 가하면 환원형으로 환원시킬 수 있다. 어떤 두 산화-환원쌍을 적절히 배합하면 산화-환원반응을 일으킬 수 있다. 따라서 산화-환원쌍을 알고 있으면 산화-환원반응에 의한 생성물을 예측할 수 있게 된다.
주어진 쌍에서 산화제가 세면 셀수록 환원 생성물은 환원제로서 더욱 더 약해진다. 산화상태가 0인 원소를 포함한 몇 가지 산화-환원쌍의 상대적 산화 및 환원경향이 [표 3]에 실려 있다. 비금속류의 원소상태는 좋은 산화제이고 알칼리 금속은 매우 좋은 환원제이다. 이러한 경향은 어느 정도 주기율표와 관계지을 수 있다.

주기율표의 왼쪽 아래에 위치한 원소들은 매우 센 환원제이고 이들 양이온은 매우 약한 산화제이다. 전이금속 이온은 산화력이 중간 정도이지만 이들 족 내에서는 산화력의 주기적 경향을 나타내지 않는다. ⅥB 및 ⅦB 족에 속하는 전이원소의 높은 산화상태에 있는 화합물들은 보통 센 산화제이며 대개 산화상태가 낮은 단순한 양이온으로 환원된다. 따라서 과망간산 이온 및 중크롬산 이온은 산성 용액에서 매우 좋은 산화제이다.
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[Chemistry/생활 속 화학] - 화학 이론 | 산과 염기 1부
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글