
산과 염기
산과 염기의 특성에 대한 최초의 기준 방법은 실험적으로 관찰된 수용액 중에서의 성질이었다. 일반적으로 산(acid)은 신맛을 내며 리트머스 시험지를 빨갛게 변화시키고 염기를 중화하는 것으로 정의하였다. 염기(base)는 쓴맛을 내며 리트머스 시험지를 푸르게 변화시키고 산을 중화하는 것으로 정의하였다. 물질의 구조에 대한 개념이 발달됨에 따라 과학자들은 산성 및 염기성과 이러한 성질을 갖고 있는 물질의 구조 사이에 대한 관계를 연구해왔다.
BrΦnsted-Lowry 이론
1923년에 Johannes BrΦnsted와 Thomas Lowry는 독자적으로 보다 넓은 산과 염기의 이론을 제안하였다. BrΦnsted-Lowry의 정의에 의하면 산은 양성자(proton)를 주는 물질이고 염기는 양성자를 받는 물질이다. 산과 염기의 반응은 양성자가 산에서 염기로 전달되는 반응이다. BrΦnsted-Lowry 이론이 적용되는 반응의 예는 다음과 같다.

이 반응에서 H2O는 산으로서 염기인 NH3에 양성자를 제공한다. 또한 역반응에서 암모늄염의 용액은 알칼리에 양성자를 제공하여 암모니아 기체를 발생시킨다. BrΦnsted-Lowry 이론에 의하면 산과 염기는 분자일 수도 있고 이온일 수도 있다. 염기인 NH3가 양성자를 받아 산인 NH4+이 되고 산인 NH4+이 양성자를 잃어 염기인 NH3가 되는데 양성자를 얻고 잃는 이 두 산-염기 쌍을 짝쌍(conjugate pair)이라고 한다. NH4+은 NH3 염기의 짝산이고 NH3은 산 NH4+의 짝염기이다. 같은 원리로 산 H2O와 염기 OH-도 또한 짝쌍이다. 짝 관계를 첨자를 사용하여 표시하면 다음과 같다.

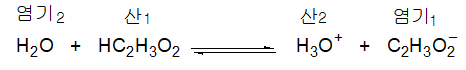
한 반응에서 산으로 작용하는 분자나 이온이 다른 반응에서는 염기로 작용하는 경우가 있다. 이러한 물질을 양쪽성(amphiprotic) 물질이라고 한다. 예로 암모니아와 물의 반응에서 물은 산으로 반응한다(짝염기 OH-). 그러나 아세트산과의 반응에서 물은 염기로 반응한다(짝산 H3O+).
산과 염기의 세기
BrΦnsted-Lowry의 이론에 따라 강산은 양성자를 다른 분자에 제공하는 경향이 큰 산이고 강염기는 양성자에 대한 친화도가 큰 염기라고 할 수 있다. 예를 들어 다음의 반응에서 반응물로부터 생성물로 어느 정도 변화하는가를 알면 산의 세기를 정량적으로 측정할 수 있을 것이다.

이 반응의 진행정도는 산1이 양성자를 제공하려는 경향과 염기2가 양성자를 받아들이려는 경향에 따라 결정된다. 산1과 염기2의 성질에 따라 양성자가 옮겨가는 정도가 다르다고 하면 개개의 산의 세기를 비교할 때는 같은 염기에 대한 양성자의 이동 경향을 측정하는 것이 정확한 방법이다.

산과 염기의 세기를 비교할 수 있는 또 하나의 방법은 맞먹는 산-염기의 짝(conjungated acid-base) 이론이다. 산의 세기와 그 맞먹는 염기의 세기와의 관계를 비교해보기로 한다. 예를 들면 HCl은 양성자를 제공하는 경향이 크므로 강산이다. 그러나 그와 맞먹는 염기인 Cl-은 양성자를 받아들이는 경향이 대단히 작으므로 확실히 약염기이다. 이와 같이 산이 강산이면 그 맞먹는 염기는 약염기이고 또 산이 약산이면 맞먹는 염기는 강염기이다.
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글