
이온 결합
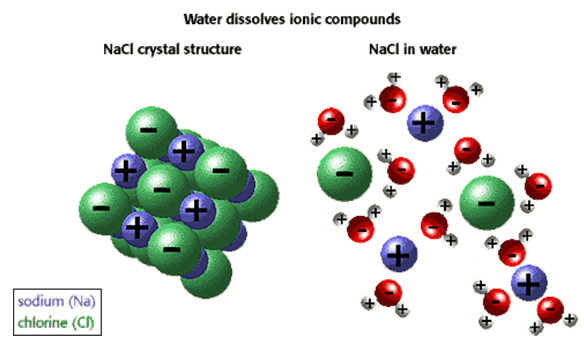
염화나트륨은 Na+ 이온과 Cl- 이온으로 구성되기 때문에 반대전하 사이에는 정전기적 인력이 작용하는데 이 결합을 이온결합(ionic bond)이라고 한다. 하전된 입자에 기인하는 인력은 모든 방향으로 작용하며 지정된 하나의 이온은 무수한 반대 하전 이온을 끌어당길 것이다. NaCl 고체의 구조는 X선 연구로 결정되었고 이때 얻은 결과로부터 반대로 하전된 입자가 규칙적으로 배열된다는 모형이 제안되었다(그림 1 참조). 이 모형은 알려진 NaCl의 성질을 아주 잘 설명해준다. 이 고체물질은 전기를 통하지 않지만 NaCl이 녹거나 물에 용해되면 구성이온들은 외부전위의 영향을 받아 자유로이 움직이며 전기를 통한다. NaCl의 물리적인 상태는 결정성이며 이 결정은 이온의 규칙적인 기하학적 배열로 이루어진다.
공유 결합
수소 기체와 같은 2원자 분자의 존재를 설명하기 위해서는 다른 모형이 필요하다. 2개의 원자가 동일하므로 반대로 하전된 이온들의 생성은 기대할 수 없다. 2개의 수소 원자가 수소 분자에서처럼 가까이 접근되었을 때 그것들의 전자는 쌍(pair)을 이룬다. 이 전자쌍은 두 원자에 의해서 공유된다. 두 원자가 한쌍의 전자를 공유함으로써 생기는 결합을 공유결합(covalent bond)이라 한다.
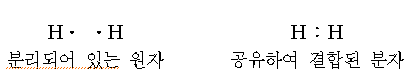
헬륨 원소는 단원자 기체로 존재하고 그 화합물은 알려져 있지 않다. 헬륨 원자에는 한 쌍의 전자가 있으며 이것의 유리원자는 다른 원소들과 결합하지 않기 때문에 분명히 가장 안정된 원자이다. H2 분자에서 2개의 수소원자는 헬륨과 비슷한 전자배치를 하고 있다.
주기율표의 주족원소들은 결합에 관여하는 전자의 수가 족의 번호와 같다. 이와 같이 결합에 관여하는 전자를 원자가전자(valence electron)라고 한다. 주기율표에서 두 번째 주기의 원자들에 대하여 원소기호와 원자가전자를 점으로써 나타내어 표시하면 다음과 같다.

네온은 헬륨처럼 매우 안정되어 있으므로 단원자 기체로 존재하며 8개의 원자가전자를 갖는다. 따라서 이 주기의 다른 원자들은 이온을 생성하거나 공유결합을 형성하여 네온의 전자배열과 같이 8개의 원자가전자를 가지려는 경향이 있다. 원자들이 서로 결합하였을 때 그 둘레에 8개의 원자가전자를 가지려는 경향을 옥테트 규칙(octet rule)이라고 한다. 대단히 가벼운 원자들은 헬륨처럼 2개의 전자를 가지려는 경향이 있다. 옥테트 규칙은 공유결합을 하는 모든 경우에 적용할 수는 없으나 간단한 분자들의 전자구조를 설명하는데 유용한 지침이 될 수 있다. 예를 들면 2개의 플루오르 원자는 한 쌍의 전자를 공유하여 다음과 같은 플루오르 분자를 생성한다.

여기서 한 쌍의 공유된 전자는 단일공유결합을 이룬다. 이렇게 공유결합을 형성한 결과 분자 내에 있는 각 플루오르 원자들은 네온과 같은 전자배치를 하게 된다. 어떤 원자는 8개의 전자를 갖기 위하여 몇 개의 다른 원자와 결합하거나 또는 이중결합(double bond)이나 삼중결합(triple bond)을 형성함으로써 2쌍 이상의 전자를 공유해야 한다. 두 원자 사이에 공유된 한 쌍의 전자들은 원자기호 사이에 그은 단일선으로 표시하는 것이 편리하다. 이중선 또는 삼중선은 이중결합 또는 삼중결합을 가리키고 여기서 공유되지 않은 전자들은 표시하지 않아도 좋다.

다원자 이온을 구성하는 원자들도 공유결합으로 결합되어 있다. 이 경우에 이온의 알짜음전하는 이온을 구성하고 있는 중성원자들이 갖고 있던 전자보다 더 많은 전자를 갖는다. 예를 들면 아염소산이온(ClO2-)은 2개의 산소 및 1개의 염소 원자가 갖고 있는 것보다 1개의 전자를 더 많이 함유하고 있다.
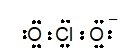
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[Chemistry/생활 속 화학] - 화학 이론 | 산과 염기 1부
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글