
액체
기체는 임계온도 이하에서 임계압력보다 큰 압력을 가하여 압축하면 액체로 변한다. 또한 고체도 가열해 주면 그 고체 분자는 격자점으로부터 뛰어나오는 데 충분한 운동에너지를 공급받아서 융해되어 액체상태로 변할 것이다. 따라서 액체상태란 기체와 고체의 중간 상태라고 볼 수 있고 그 성질도 양자의 중간적인 성질을 나타낼 것이다. 액체는 일정한 부피를 갖고 있기 때문에 그 액체를 둘러싸고 있는 공간 사이에는 경계면이 있다. 일정한 경계면에 의하여 다른 물질과 분리된 물질의 균일한 부분을 상(phase)이라 한다.
① 점성도
액체의 유동성은 흐르는데 대한 저항을 측정한 값인 점성도(viscosity)로 나타낸다. 점성도가 크면 천천히 흐르며 이는 주어진 부피가 좁은 관을 통과하는데 걸리는 시간을 관측하여 측정한다. 즉 점성도가 크면 [그림 1]의 a 표시선에서 b 표시선까지 흐르는 시간이 더 길어진다. 실온에서 조청이나 용융 유리같이 점성도가 큰 액체는 끈끈하다.
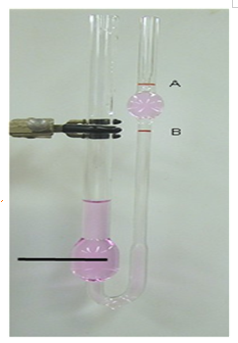
액체의 점성도는 분자 사이의 힘 때문에 발생한다. 힘이 강할수록 분자들의 운동을 방해하여 점성도가 커진다. 수소결합은 이웃 분자들을 아주 강하게 묶으므로 수소결합이 없는 벤젠보다 물이 더 큰 점성도를 갖는다. 인산(H3PO4)과 글리세롤(C3H8O3)도 많은 수소결합을 갖고 있기 때문에 실온에서 점성도가 매우 높다.
그러나 무거운 탄화수소 기름들은 수소결합이 없는데도 점성도가 높은데 그 이유는 분자 사이에 형성되는 London 힘의 영향과 분자구조의 형태 즉, 긴 사슬형태 분자가 서로 꼬이기 때문이라고 생각된다. 많은 액체의 점성도는 온도가 증가하면 감소하는데 이는 분자가 높은 온도에서 에너지를 더 많이 가지므로 더 쉽게 이웃 원자들 옆을 지나 갈 수 있기 때문이다. 예를 들면 100℃에서 물의 점성도는 0℃의 1/6로서 같은 양이 6배나 더 빨리 관을 통과한다.

② 표면장력
분자간 힘에 관계되는 액체의 또 다른 성질은 표면장력(surface tension)이며, 이것은 1㎠당 표면적을 넓히는데 소요되는 일(에너지)로 정의된다. 액체 내부에 있는 분자는 이를 둘러싸고 있는 분자들에 의하여 모든 방향으로 약간씩 균일하게 끌린다(그림 2 참조). 그러나 액체의 표면에 있는 분자는 액체 내부를 향한 알짜 인력만을 갖고 있기 때문에 가능한 한 액체의 표면적을 작게 하려는 경향이 있다. 유리판 위에 떨어진 물방울이나 수은방울은 거의 둥근 모양을 이룬다. 이 구형체는 어떤 기하학적 형태보다도 단위부피당 표면적이 가장 작다. 따라서 이 구형체는 다른 어떤 형태보다도 표면 에너지가 작다. 모세관 내에서 액체의 상승은 표면장력에 의하여 일어나는 현상이다. 모세관 내에서 액체의 상승 여부는 액체 분자 상호간의 인력과 모세관 벽에 대한 액체 분자들의 인력과의 비율에 따른다.
용액
용액(solution)은 균일한 혼합물이다. 용액중에 가장 많이 존재하는 성분을 용매(solvent)라 부르고, 다른 성분들을 용질(solute)이라고 부른다. 용매와 용질은 반드시 구분해서 쓰여지는 것은 아니다. 때로는 소량으로 존재하는 성분을 용매로 표시하는 것이 오히려 편리한 경우도 있고, 기체 혼합물을 다룰 때와 같이 용매와 용질을 구별하는 것이 무의미한 경우도 있다.

일정한 양의 용매에 녹아 있는 용질의 양은 그 용질의 농도(concentration)로서 표시한다. 비교적 낮은 농도를 갖는 용액을 묽은 용액(dilute solution)이라고 부르고 비교적 높은 농도의 것을 진한 용액(concentrated solution)이라고 부른다. 만일 용질이 액체 용매에 정상적으로 녹는 것보다 과량이 첨가되면 용액은 순수 용질과 공존하고 용해된 용질과 순수 용질 사이에는 다음과 같은 평형관계가 성립된다.

순수한 용질은 고체, 액체 또는 기체일 수도 있다. 평형에 도달된 이러한 계에서는 순수 용질이 녹는 속도와 용해된 용질이 용액으로부터 이탈하는 속도가 서로 같아서 용질의 농도는 일정하게 유지된다. 이러한 용액을 포화용액(saturated solution)이라 부르고, 이 농도가 주어진 온도에서 그 용질의 용해도(solubility)값이 된다(그림 3 참조).
불포화용액(unsaturated solution)은 포화용액보다 낮은 농도를 가진다. 때로는 용질의 농도가 포화용액보다 높은 과포화용액(supersaturated solution)도 얻어진다. 과포화용액은 불안정하여 만약 고체 용질을 용액 중에 소량 넣어주면 과량으로 녹아 있는 용질은 즉시 석출된다.
용해도에 영향을 주는 요인
한 물질이 다른 물질에 녹아 들어가는 정도는 용매와 용질의 성질에 의존할 뿐만 아니라 온도에도 영향을 받으며 특히 기체일 경우에는 압력의 영향을 받게 된다.
① 용해도와 분자구조
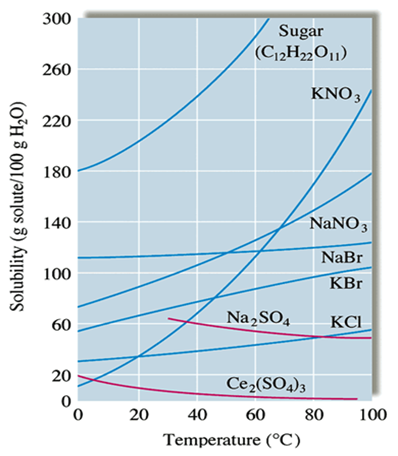
용액을 형성하는 요인들에 관한 고찰을 통하여 분자구조를 더 많이 이해 할 수 있다. 몇 가지 대표적인 기체들의 물에 대한 용해도 자료를 비교하여 보면 [표 2]와 같이 분자량이 커짐에 따라서 용해도가 증가함을 알 수 있다.

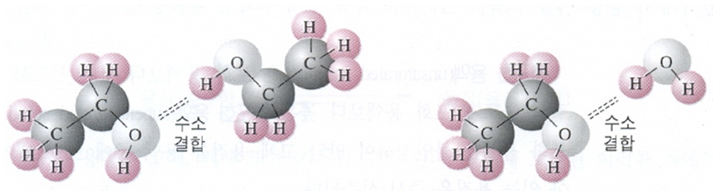
그리고 극성액체는 극성용매에 녹기 쉽다. 예를 들면 아세톤과 같은 극성 분자는 물과 어떤 비율이라도 섞일 수 있다. 또한 용매와 용질 사이에 수소결합을 일으키면 높은 용해도를 나타낸다. 물과 에틸알코올(CH3CH2OH)은 완전히 섞인다. [그림 4]에 나타낸 바와 같이 에틸알코올은 그들 분자들 사이에 작용하는 것처럼 물분자와 수소결합을 한다.
② 용해도에 미치는 온도의 영향
어떤 물질의 용해도에 대한 온도의 영향은 포화용액을 만들 때 열을 흡수하는가 또는 방출하는가에 따라서 좌우된다. 거의 포화된 용액에 어떤 용질 소량을 넣었더니 열을 흡수하면서 녹았다고 가정하자. 일반적으로 과량의 고체 용질과 녹아 있는 용질 사이에는 다음과 같은 평형이 이루어진다.
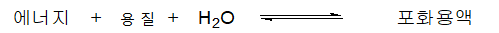
포화에 가까운 용액에서 용질이 녹을 때 열을 흡수하는 물질의 용해도는 온도의 상승과 함께 증가한다. 이온성 물질은 대부분 이처럼 행동한다. 어떤 물질이 포화에 가까운 용액에서 열을 발생하면서 녹을 때 Le Châtelier의 원리에 의해서 평형계의 온도를 내려주면 이러한 용질의 용해도는 증가되고 온도를 올려주면 감소함을 예측할 수가 있다. 몇 개의 이온성 화합물(Li2CO3와 Na2SO4)들은 이와 같이 행동한다. 또한 모든 기체의 용해도는 온도를 올려주면 감소한다. 탄산 음료수를 가열하면 탄산가스의 기포가 발생되는 것을 볼 수가 있다.

온도 변화가 용해도에 미치는 영향과 용해열 사이의 관계를 보면 일반적으로 적은 용해열을 갖는 물질의 용해도는 온도변화의 영향을 별로 받지 않는다.
③ 용해도에 미치는 압력의 영향
일반적으로 압력의 변화는 물에 대한 액체 또는 고체의 용해도에 거의 영향을 미치지 않는다. 반면에 기체의 용해도는 압력에 의해 크게 영향을 받는다. 기체의 용해도에 대한 압력 변화의 정상적인 효과는 Le Châtelier의 원리로 예측할 수 있다. Le Châtelier의 원리에 따르면 물리적 또는 화학적 평형에 있는 계를 어떤 방법으로 변화시킨다면 그 계는 물리적 또는 화학적 변화가 일어나서 이 조건의 변화를 감소시키는 방향으로 평형이 이동된다.
[그림 5]과 같이 움직일 수 있는 피스톤으로 장치된 원통형 용기에 포화수용액과 이산화탄소 기체가 들어 있다고 생각하자. 이산화탄소의 분압은 피스톤을 아래로 밀었을 때 순간적으로 증가한다. Le Châtelier의 원리에 따라 더 많은 기체가 용해되면 이산화탄소의 압력이 감소하게 되어 피스톤에 의한 압력 증가의 효과가 줄어든다. 그러므로 더 높은 압력 하에서는 이산화탄소가 더 많이 녹게 됨을 예측할 수 있다.
이와는 반대로 이산화탄소 기체의 분압이 감소되면 용해도는 감소한다. 탄산음료의 병뚜껑을 열면 쉬잇하는 소리가 난다. 이것은 이산화탄소의 분압이 감소함에 따라 용액으로부터 기체가 빠져나오기 때문이다. 이산화탄소에 대한 압력의 영향은 다른 기체에도 적용된다. 그러므로 모든 기체는 주어진 온도에서 용액 위의 기체의 부분압력을 증가시키면 액체에 더 많이 용해된다.

일정한 온도하에서 일정량의 용매 중에 녹아 있는 기체의 양은 그 기체의 분압에 직접 비례한다는 사실은 1903년 William Henry가 발견하였다. 이 Henry의 법칙은 묽은 용액과 낮은 압력범위에서 잘 성립한다.
[X] = KPX
여기서 [X]는 용해된 기체의 농도이며, PX는 용액 위의 기체 분압 그리고 K는 Henry 법칙의 상수이다. 어떤 압력에 대한 기체의 용해도를 알면 Henry 법칙의 상수를 계산할 수 있으며 이것을 이용하여 다른 기체 압력에서의 용해도를 계산할 수 있다.
삼투압
어떤 용매에 용질을 가하면 용질은 용매 전체에 퍼져서 균일한 농도가 된다. 농도가 서로 다른 용액 사이에서 용액 분자만을 통과시키고 용질 분자는 통과시키지 못하는 막을 설치하면 묽은 용액으로부터 진한 용액 쪽으로 용매 분자가 이동한다. 이 현상을 삼투(osmosis)라 하고 이와 같은 성질을 가진 막을 반투막(semipermeable membrane)이라 하며 동물의 방광, 황산지 등이 좋은 예이다. 또한 페로시안화구리, Cu2Fe(CN)6,의 침전도 거의 완전한 반투막이다.

[그림 6]에 표시한 장치에서 용매 분자는 묽은 용액에서 진한 용액으로 이동하여 용액의 액면이 점차 상승한다. 이때 어느 높이 h만큼 상승하면 삼투 현상이 정지된다. h만큼 상승한 용액의 액면 높이가 유지되기 위하여서는 높이 h의 용액기둥에 가해질 압력이 필요하다. 이러한 압력 즉, 반투막을 통하여 용매가 용액 쪽으로 이동하는 것을 막기 위하여 용액이 가져야 하는 여분의 압력을 삼투압(osmotic pressure)이라 한다.
콜로이드
소금, 알코올, 설탕 등의 수용액은 용질 분자의 크기가 1㎛ 이하이다. 이와 같은 용액을 진용액(true solution)이라 한다. 이에 반해서 전분, 단백질, 폴리비닐알코올 등의 수용액에서는 용질 분자의 크기가 1㎛보다 크다. 용질 입자의 크기가 1㎛~100㎛인 용액은 진용액과 성질이 다르다. 이러한 용액을 콜로이드 용액(colloidal solution)이라 하고 콜로이드 용액을 만드는 입자를 콜로이드라고 한다. 이것은 눈이나 보통 현미경으로 직접 볼 수 있는 물질의 크기와 보통의 원자, 분자 혹은 이온 크기의 중간에 위치하고 있다. 우리 생활 주변에는 우유나 비누거품처럼 콜로이드 상태에 있는 것들이 많이 있다.
콜로이드 분산계(dispersion system)에서 진용액의 용매에 해당하는 것을 분산매(dispersion medium), 용질에 해당되는 것을 분산질(dispersed phase)이라고 한다. [표 3]에 콜로이드 분산계를 표시하였다. 이 표에서 기체와 기체는 서로 균일하게 혼합되므로 콜로이드 분산계를 만들지 않는다. 콜로이드는 용해도에 의해 두 가지로 분류한다. 즉 아교나 우유같이 물 속에 분산되어 안정한 콜로이드를 만드는 것을 친수성 콜로이드(hydrophilic colloid)라 하고, 기름이나 금속같이 쉽게 엉켜서 덩어리가 되는 것을 소수성 콜로이드(hydrophobic colloid)라고 한다. 콜로이드 용액은 투석, 틴달현상, 브라운 운동, 전기이동 및 흡착작용 등의 특유한 성질들을 갖고 있으며, 앞으로 산업 분야에 이같은 특성들이 활발히 응용될 것으로 전망된다.
|
분 산 질 |
분산매 |
명 칭 |
예 |
|
고 체
|
기체 |
에어로졸 |
연기 |
|
액체 |
졸 혹은 서스펜소이드 |
금, 은 |
|
|
고체 |
고체 콜로이드 |
색유리, 유리 |
|
|
액 체
|
기체 |
에어로졸 |
안개, 구름 |
|
액체 |
에멀션 |
우유, 크림, 버터 |
|
|
고체 |
젤 |
젤리 |
|
|
기 체
|
기체 |
― |
없음 |
|
액체 |
거품 |
맥주거품 |
|
|
고체 |
고체 콜로이드 |
부석 |
표 3 콜로이드 분산계의 종류
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 산과 염기 1부
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글