
Lewis 이론
Gilbert N. Lewis는 BrΦnsted-Lowry의 양성자에 의한 산-염기 이론보다 더 넓은 개념을 제안하였다. Lewis는 원자, 분자 혹은 이온과 공유결합을 할 수 있는 비공유 전자쌍을 가진 물질을 염기라 하고 이 염기로부터 전자쌍을 받음으로써 공유결합을 형성할 수 있는 물질을 산이라고 정의하였다. Lewis는 전자쌍(electron pair)의 주고 받음에 의한 개념으로 다른 산-염기 이론에서 다룰 수 없는 산-염기 반응을 설명할 수 있다.

BrΦnsted-Lowry 이론의 염기는 Lewis 이론에서도 역시 염기이며 산의 경우도 마찬가지가 된다. Lewis 산-염기가 어떻게 유도되었는지 보기 위해서 산화바륨과 황산의 반응 및 산화바륨과 삼산화황의 반응으로부터 생성된 황산바륨을 생각해 보기로 한다.
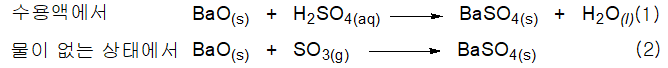
이온으로 나타낸 반응물로 반응식(1)을 다시 적으면 다음과 같다.

BrΦnsted-Lowry의 양성자 이동 관점에서 반응식(3)을 산-염기 반응으로 볼수 있다.
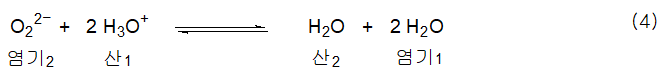
반응식(4)는 전자쌍을 주는 것이 분명하도록 다음과 같이 표시할 수도 있다.

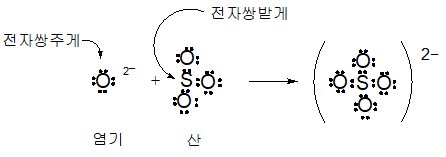
또 반응식(2)에 대해서도 다음과 같이 전자쌍의 변화를 표시할 수 있다.
물의 이온화 평형
물은 양쪽성이므로 물이 그 자체와 반응한다는 것은 놀라운 일이 아니다.

이러한 평형은 순수한 물과 모든 묽은 수용액에서 이루어지며 이때의 평형상수식은 다음과 같이 표시된다.
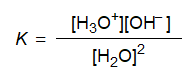
이것을 변형하면 다음과 같다.
K[H2O]2 = [H3O+][OH-]
묽은 수용액에서 물의 농도, [H2O]는 일정하다고 생각할 수 있으므로 Kw항이 K[H2O]2로서 정의되며, 이를 물에 대한 이온곱상수(ion product constant)라고 부른다.
Kw = [H3O+][OH-]
이 식은 존재하는 산이나 염기의 종류에 관계없이 모든 묽은 수용액에 대하여 적용된다. 25℃에서 측정한 Kw 값은 1.008×10-14로 이 값은 온도가 증가하면 증가한다. 예로써 60℃에서는 Kw 값이 9.6×10-14 이다. 오차를 감안하면 25℃에서 Kw 값은 보통 다음과 같이 된다.
Kw = 1.00×10-14
순수한 물에서는 [H3O+]=[OH-]이므로 25℃에서 다음과 같이 적을 수 있다.
[H3O+] = [OH-] = 1.00×10-7mole/L
순수한 물은 중성으로서 [H3O+]와 [OH-]는 같다. 만약 물에 [H3O+]을 증가시키는 물질을 더하면 Le Châtelier의 원리에 의하여 [OH-]는 감소해야만 한다. 산성 용액에서는 [H3O+] > 1×10-7mole/L이고 알칼리성 용액에서는 [OH-] > 1×10-7mole/L 이다. 따라서 H3O+ 농도가 크면 클수록 용액은 강한 산성이며, OH-의 농도가 크면 클수록 용액은 강한 알칼리성이다.
pH 척도
[H3O+] 또는 [OH-]의 농도값은 정수가 아니어서 사용하는데 불편할 때가 많다. 따라서 이는 대수 표시로서 정수의 편리한 숫자로 표현할 수 있는데 그 관계식은 다음과 같다.
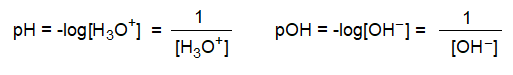
물의 이온곱에 대한 표현은 다음과 같이 쓸 수 있다.
Kw = [H3O+][OH-]
logKw = log([H3O+][OH-]) = log[H3O+] + log[OH-]
-logKw = -log[H3O+] - log[OH-]
pKw = pH + pOH
물의 이온곱상수는 1.00×10-14이므로
pKw = -log(1.00×10-14) = 14.00
pH + pOH = 14.00
pH = 14.00 - pOH
pOH = 14.00 - pH
따라서 중성 용액에 대하여 다음과 같이 나타낼 수 있다.
pH = pOH = 7.00
pH가 7.00보다 작으면 용액은 산성 용액이고 pH가 7.00보다 크면 알칼리성 용액이다. 마찬가지로 산성용액은 7.00보다 더 큰 pOH 값으로 나타나며 알칼리성 용액은 pOH 값이 7.00보다 더 작다. 7.00로부터 많이 벗어날수록 그 용액은 보다 강한 산성 또는 알칼리성을 나타낸다(표 1 참조).
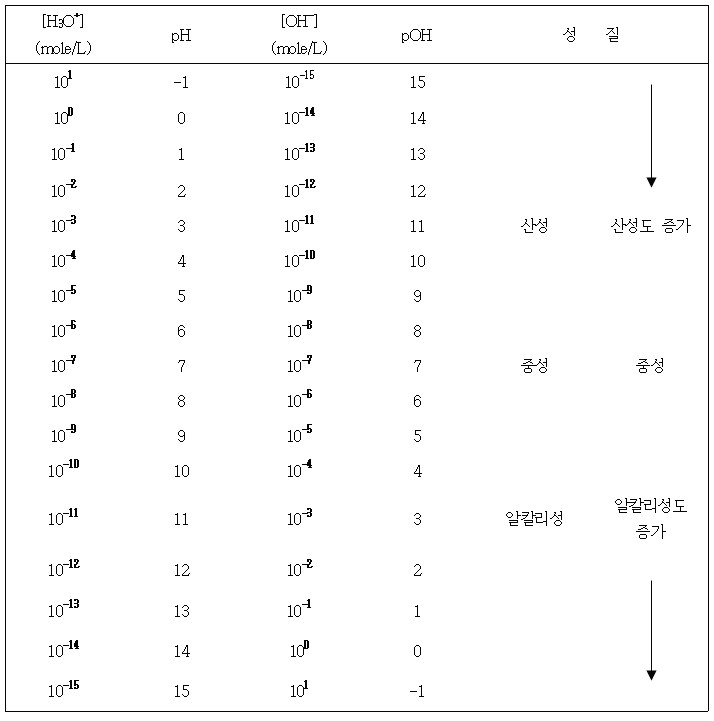
pH 및 pOH 척도는 직선이 아닌 대수이다. 예로서 pH 1의 용액은 pH 2의 용액을 갖는 수소 이온 농도의 열 배를 갖고 있으며 두 배가 아니다. pH 12의 용액은 pH 10의 용액이 갖고 있는 수산화 이온 농도의 백 배를 갖고 있다. pH와 pOH가 모두 유용함에도 불구하고 수용액에서 산성과 알칼리성을 표시하는데 pH를 보편적으로 많이 사용하고 있다.
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 분자와 이온
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글