
분자
분자(molecule)는 순수한 물질의 조성과 화학적 성질을 갖고 있는 물체의 가장 작은 입자를 말하고 독립적으로 존재할 수 있다. 기체인 산소는 두 개의 원자가 한 분자로 되어 있는 이원자 분자(diatomic molecule)로 존재한다. 즉, 산소 분자는 화학반응으로 두 개의 산소 원자로 쪼갤 수 있고, 이 산소 원자는 다른 원자나 분자들과 결합할 수 있다. 실제로 결합은 대단히 빨리 일어나는데 그 이유는 산소 원자가 어느 순간도 독립적으로 존재할 수 없기 때문이다. 산소의 화학식은 O2로 나타내며 첨자인 2는 한 분자내에 두 개의 산소 원자가 존재한다는 것을 말한다.
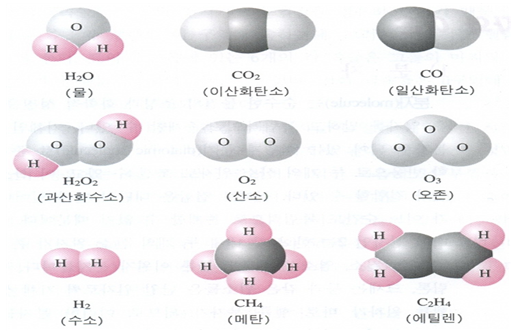
수소, 질소, 염소 분자들도 물론 이원자 분자들이다. 반면 헬륨, 네온, 아르곤, 크립톤, 크세논 등과 같은 원소들은 단일 원자로써 기체상태로 존재한다. 즉 헬륨은 헬륨 원자가 바로 헬륨 분자가 되므로 이러한 분자들을 단원자 분자(monoatomic molecule)라고 한다. 황과 인처럼 두 개보다 많은 원자를 갖고 있는 분자 즉, 다원자 분자(polyatomic molecule)인 원소들도 있다(그림 1 참조).
분자들은 두 개 내지 수백개의 원자들을 가질 수 있다. 즉 탄소 원자 한 개와 산소 원자 한 개로 구성된 일산화탄소 CO처럼 간단한 이원자 분자도 있으며, 녹색식물에서 태양 에너지를 저장할 수 있는 천연 화합물인 엽록소 a와 같은 거대한 분자도 있다. 엽록소 a 분자는 탄소, 수소, 질소, 산소 등의 137개 원자들로 구성되어 있다.
또 끝없는 사슬처럼 생긴 중합체의 분자들도 있다. 각각의 분자들은 10-24 내지는 10-21g의 무게를 가지며 그 분자 지름은 10-8cm 즉 0.1nm의 범위에 해당한다. 분자형태로 존재하는 물질의 분자식은 실험식과 그 분자량으로부터 추정할 수 있다. 분자량은 질량이 알려진 물질의 몰수를 구하면 알 수 있다. 어느 특정의 질량을 가진 순수한 물질의 몰수는 그 물질의 그램수를 몰당의 그램수, 즉 분자량 또는 화학식량으로 나누면 쉽게 계산된다.

몰(mole)은 그 물질의 화학식 단위인 아보가드로(Avogadro)수를 가리킨다. 예를 들면 1몰의 NaCl은 6.02×1023개의 Na+ 및 동수의 Cl-를 포함한다. 그리고 NaCl 1몰의 질량은 58.443g이다.
이온
전하를 띤 원자나 원자단을 이온(ion)이라고 한다(표 1 참조). 만일 전자가 중성원자나 분자로부터 제거되면, 양성자가 남아 있는 전자의 수보다 많게 되므로 양이온이 생성된다(그림 2참조). 마찬가지로 한 원자가 자신의 양성자수 보다 더 많은 전자를 가지게 되면 그 원자는 음이온이 된다(그림 3 참조).
이온을 표기하는 방법으로는 Na+, Al3+, Cl- 등과 같이 원소기호의 오른쪽 위에 전하를 표시한다. 대부분의 화합물들은 부호가 서로 반대인 전하를 띠는 이온들로 구성된다. 각 화합물은 양이온과 음이온의 상대적 수가 서로 정확히 상쇄하도록 되어 있기 때문에 전기적으로 중성이다. 예를 들면 소금 즉, 염화나트륨은 같은 수의 Na+ 이온과 Cl- 이온으로 구성되어 있다.


이온을 포함하는 용액이 [그림 4]과 같은 장치에서 두 전극 사이에 들어 있으면 각 이온은 그 이온의 전하와 반대되는 전극 쪽으로 이동할 것이다. 고체의 소금은 전기를 전도하지 않지만 용해된 소금은 전기를 전도한다. 이온을 통하여 전기를 전도하는 물질을 전해질(electrolyte)이라고 한다.

용액상태에서 전기를 잘 전도하는 물질을 센 전해질(strong electrolyte)이라고 하며, 약하게 전기를 전도하는 물질을 약한 전해질(weak electrolyte)이라고 한다. 그러나 순수한 상태에서나 용액 상태에서 이온으로 구성되지도 않고 이온을 만들지도 않는 화합물은 비전해질(nonelectrolyte)이라고 한다. 이러한 화합물은 녹아 있거나 물에 용해되어 있어도 전기를 전도하지 못한다.
|
단원자 이온 |
다원자 이온 |
|||
|
Li+ |
Al3+ |
NH4+ |
ammonium |
암모늄 이온 |
|
Na+ |
Sb3+ |
BrO3- |
bromate |
브롬산 이온 |
|
K+ |
Bi3+ |
CN- |
cyanide |
시안화 이온 |
|
Rb+ |
Cr3+ |
CO3- |
carbonate |
탄산 이온 |
|
Cs+ |
Fe3+ |
ClO4- |
perchlorate |
과염소산 이온 |
|
Cu+ |
Co2+ |
Cr2O42- |
chromate |
크롬산 이온 |
|
Ag+ |
Mn2+ |
Cr2O72- |
dichromate |
중크롬산 이온 |
|
Be2+ |
Sn2+ |
MnO4- |
permanganate |
과망간산 이온 |
|
Mg2+ |
F- |
NO2- |
nitrite |
아질산 이온 |
|
Ca2+ |
Cl- |
NO3- |
nitrate |
질산 이온 |
|
Sr2+ |
Br- |
O22- |
peroxide |
과산화 이온 |
|
Ba2+ |
Ι- |
OH- |
hydroxide |
수산화 이온 |
|
Cu2+ |
O2- |
PO43- |
orthophosphate |
오르토인산 이온 |
|
Zn2+ |
S2- |
SO32- |
sulfite |
아황산 이온 |
|
Cd2+ |
N3- |
SO42- |
sulfate |
황산 이온 |
표 1 몇 가지 일반적인 이온들
[Chemistry/생활 속 화학] - 화학 이론 | 화학의 영역
[Chemistry/생활 속 화학] - 화학 이론 | 원자
[Chemistry/생활 속 화학] - 화학 이론 | 주기율 표
[Chemistry/생활 속 화학] - 화학 이론 | 전자배치
[Chemistry/생활 속 화학] - 화학 이론 | 화학식
[Chemistry/생활 속 화학] - 화학 이론 | 화학 결합
[Chemistry/생활 속 화학] - 화학 이론 | 산화와 환원
[Chemistry/생활 속 화학] - 화학 이론 | 액체와 용액
[Chemistry/생활 속 화학] - 화학 이론 | 산과 염기 1부
[일반화학]화학의 이론 레포트
1. 화학의 영역 화학이란 물체의 구성이나 성질 및 구조에 대하여 연구하는 학문이다. 어떤 물체는 하나 또는 그 이상의 화학원소로 이루어져 있다. 원소(element)란 화학반응에 의하여 간단한 형태로 더 이상 분해되지 않는 물체의 한 형태이다. 현재 100개가 넘는 원소들이 알려져 있으며 한 원소는 다른 원소들과 구별되는 고유한 특성이 있다. 각 원소의 기호(symbol)는 주로 영어나 라틴어의 약자로 표시되었고, 이 기호는 원소의 원자를 표시하는데 사
www.happycampus.com


댓글