1. 약물동태학 개요
1.1. 약물동태학의 정의
약물동태학(Pharmacokinetics)이란 생체에 투여된 약물이 생체내에서 겪는 흡수(absorption), 분포(distribution), 대사(metabolism) 및 배설(excretion) 과정을 시간의 함수로 정량적으로 평가하는 학문으로, 신약개발에서 약물동태를 이해하는 것은 신약후보물질 선정 및 개발 가능성을 약물동태학을 통하여 약효 및 독성 발현 여부에 대한 가능성과 그 확률적인 부분을 설명해 줄 수 있다.
약물의 약효 및 독성을 발현 가능성을 파악하기 위해서는 약물 작용부위에서의 약물농도를 관찰하는 것이 필요하지만 현실적으로 각 수용체에 노출되는 약물 농도를 관찰할 수 없거나 직접적인 측정에 어려우므로, 혈장에서의 약물농도를 측정하고 혈장 약물농도와 수용체 약물농도 사이의 예측 가능한 상관관계를 설명함으로서 약물의 체내동태를 파악할 수 있다. 약물을 경구, 정맥, 혹은 다른 투여경로로 투여하고 시간에 따른 혈장중 약물의 농도를 분석하여 그 관계를 규명하는 것이 약물동태 파악을 위한 기본 개념이다.
1.2. 약물의 흡수, 분포, 대사 및 배설 과정
약물은 다양한 경로를 통해서 체내로 들어와 흡수, 분포, 대사, 배설의 과정을 거친다. 정맥투여와 같이 투여 즉시 흡수되는 경우가 아니면 약물은 그 효과를 내기 위해서 전신순환계에 도달하는 흡수의 과정을 거치게 된다. 흡수된 약물은 전신순환계를 통하여 다양한 조직과 체액으로 분포하게 되어 약효나 독성을 나타내게 된다.
또한 약물은 대사효소가 존재하는 조직에서 약물의 구조적 변화를 받는 과정(대사)을 거칠 수 있으며, 이러한 일련의 과정을 거친 후 생체시스템에서 제거되는 과정(배설)을 거쳐서 체내에 그 약효와 독성 발현이 감소되게 된다. 이러한 약물의 생체 내에서 과정을 흡수, 분포, 대사 및 배설 과정이라고 부르며 영어 첫 글자를 따서 약자로 ADME 과정이라고도 부른다.
이러한 ADME 과정은 약물이 생체내 시스템에 의해 변화되는 양적 변화를 추적하게 되는데 이 중 흡수, 분포, 배설은 약물의 양적 변화만 나타나는 물리적 변화 과정 (physical process) 이며, 대사 과정은 약물의 구조적 변화를 통하여 양적 변화가 수반되므로 화학적 과정 (chemical process)이 주요 부분을 이루게 된다.
2. 신약개발을 위한 주요 체내동태 파라미터 및 그 의미
약물은 생체 내에서 흡수, 분포, 대사, 배설과 같은 과정을 거치면서 조직과 체액에서의 농도가 변하기 때문에 생체 내에서의 약물의 농도 변화는 매우 복잡하게 해석될 수 있다. 특히 생체시스템과 관련한 부분은 여러 가지 기초 생물학 연구의 발전에 띠라서 현재도 연구되고 있는 점이 많이 있으며 앞으로도 그 해석에 있어서 계속 변화해 나갈 것으로 예상된다.
하지만, 체내에서의 약물동태를 예측하고 또 평가하기 위하여 체내에서의 이러한 과정들을 단순화시키기 위한 방법의 한가지로 수학적 원리를 이용하여 각 경우에 맞는 체내동태학적 모델을 적용시키고 응용하는 과정이 필요하며 이를 위해서 기본적인 체내동태 해석과정을 거치게 된다. 수학적 원리를 적용하기 위해서 어떠한 생체 모델이 채택되어야 하며 기본적으로 구획 모델(compartment model)을 이용하게 된다.
필요에 따라서 한 구획 모델(one-compartment model), 두 구획 모델(two- compartment model), 다 구획 모델(multi-compartment model) 혹은 구획 모델이 필요하지 않은 모델(non-compartment model) 등이 이용된다. 일반적으로 약물이 생체 시스템에 투여된 후, 혈액 중 농도를 분석하여 시간에 따른 혈중약물 농도곡선을 그릴 수 있으며 이로부터 많은 체내동태 파라미터(pharmacokinetic parameter)를 구할 수 있게 된다. 대표적 인 체내동태 파라미터로는 곡선하면적(area under the curve, AUC), 클리어런스(clearance, CL), 분포용적(volume of distribution, Vd), 반감기(half-life, t1/2), 최고혈중농도(Cmax), 최고혈중농도 도달시간(Tmax), 생체이용률(bioavailability, BA, F) 등이 있다. 이상의 주요 체내동태 파라미터를 정리할 수 있다.
2.1 혈중농도-시간 곡선 (Blood concentration-time curve)
약물을 생체시스템에 투여한 이후 시간에 따른 혈액 중 농도를 측정하여 혈중농도-시간 곡선을 그릴 수 있다. 혈액 중 농도로서 일반적으로 약물이 주로 분포하고 있는 혈장에서의 농도가 가장 많이 이용된다. 대부분의 생체시스템에서의 시간에 따른 약물농도의 변화양식은 농도자체에 비례하여 지속적으로 변하는 l 차 반응속도를 따르게 되므로 혈중농도-시간 곡선은 세로축의 농도 값을 로그형태로 표시하는 세미로그(semi-log scale)로 그래프를 그렸을 때 혈중농도곡선은 직선의 형태로 나타나게 된다.
2.2 곡선하면적 (Area under the curve, AUC)
체내통태 해석을 위해서 일반적으로 혈중농도-시간이 가장 많이 이용된다. AUC 값은 생체시스템으로 투여된 약물이 전신순환계에 노출된 약물의 양을 의미하며 이는 곧 생체시스템에 반영되는 약물의 약효 및 독성 발현 정도와 밀접한 관계가 있다. AUC 값은 정맥투여의 경우 클리어런스를 결정하는데 직접적으로 사용될 수 있으며, 경구투여의 경우에도 약물의 생체시스템에 노출된 양을 결정함으로써 전체적인 약물의 약효와 독성 발현의 정도를 예측할 수 있는 중요한 체내동태 파라미터이다.
2.3 클리어런스 (Clearance, CL)
클리어런스란 체내에서 약물이 제거되는 정도를 나타내며 약물의 체내동태를 평가하는 중요 지표로서 사용된다. 일반적인 정맥투여의 경우 약물의 혈중농도는 투여속도와 약물의 분포 그리고 클리어런스에 의해서 영향을 받는다. 또한 이러한 클리어런스와 약물의 분포는 반감기를 결정한다. 클리어런스를 나타내는 식은 다음과 같은 식에 의해서 계산할 수 있으며 그 단위는 부피/시간(volume/time) 이다.

이 식을 기반으로 클리어런스를 다른 방법으로 표현해 보면 단위시간당 농도에 비례하여 체내에서 소실되는 약물의 부피적 개념의 양을 나타내며, 이는 약물이 혈중에서 비가역적으로 소실되는 속도의 혈중약물농도에 대한 비율을 나타낸다. 즉, 약물의 제거속도를 절대적 양의 개념의 표현하는 것이 아니라 생체의 약물반응이 농도기반의 1차 반응속도를 따르는 점이 반영되어, 약물의 농도의 개념이 반영된 약물이 체내에서 소실되는 속도를 의미한다.
또한 클리어런스값의 계산은 용량과 AUC값의 비율로부터 계산되는 바, 특정 용량에서는 AUC 값과 직접적으로 반비례 관계에 있는 값이다. 따라서 정맥투여의 경우 AUC 값이 크면 클리어런스는 작게 나타나고 AUC 값이 작으면 클리어런스는 높게 나타난다 일반적인 약효나 독성의 발현은 AUC 값이 높을수록 클리어런스값이 작을수록 높게 나타날 가능성이 높다고 할 수 있다.
2.4 분포용적 (Volume of distribution, Vd)
겉보기 분포용적 (apparent volume of distribution)은 정확한 생리학적 의미를 가지는 것이 아니라 약물의 투여량과 약물의 초기농도(C0)에 의해서 결정되는 가상적인 파라미터를 뜻한다. 왜냐하면 약물의 초기농도(C0)란 혈액약물농도곡선에서 초기 시간 농도를 역추적하여 계산되는 가상적인 시간인 초기시간(0시간)에서의 약물농도를 뜻하기 때문이다. 분포용적은 약물의 체내 분포를 나타내며 적절한 약물용량을 결정하는데 있어서 중요한 파라미터라고 할 수 있다. 정상상태(steady-state)에서의 분포용적을 Vss 로 표현한다.
2.5 반감기 (t1/2)
약물의 소실속도와 관련된 또 다른 중요한 파라미터는 반감기이다. 반감기는 혈중약물농도가 반으로 줄어드는데 필요한 시간이며 이는 보통 약물 작용지속시간과 관련이 있으며 약물의 투여간격을 결정하는데 중요한 파라미터로 사용된다.
2.6 최고혈중농도 (Cmax)와 최고혈중농도 도달시간 (Tmax)
약물을 생체시스템에 투여한 이후 얻어진 혈중농도-시간 곡선에서 가장 높은 혈중농도를 최고혈중농도 (Cmax)라고 정의하고 그때까지 도달한 시간을 최고혈중농도 도달시간(Tmax) 이라 부른다. 이 Cmax 와 Tmax는 전신순환계에 도달하는데 시간이 걸리는 생체시스템에 투여했을 때 표시되는 파라미터로서 전신순환계에 약물이 가장 많이 도달한 양과 시간을 의미한다. 이 값들과 더불어 그때까지의 흡수속도상수 (absorption rate constant, ka)는 약물의 전신순환으로의 흡수가 얼마나 빠르게 도달하는지를 평가하는 중요한 요소이다.
2.7 생체이용률 (bioavailability, F or BA)
전신순환계에 도달하는 약물의 용량을 나타내는 비율이며, 특히 정맥투여 대비 다른 투여경로의 AUC값으로부터 그 값이 결정된다. 경구투여의 경우를 예로 들면 다음과 같은 식에 의해서 생체이용률 값을 계산할 수 있다.

생체이용률이 낮은 약물은 전신순환계로 완전히 흡수되지 않거나 혹은 전신순환계에 도달하기 전에 간에서 제거되는 초회통과효과(hepatic flfst-pass etfect)를 거칠 가능성이 높다. 따라서 경구치료제의 경우 생체이용률 값에 의해서 약효의 발현과 밀접한 관계가 있으므로 일반적인 경구치료제 신약개발에서 비교 파라미터로 많이 이용되는 값이다.
2.8 그 외 체내동태 파라미터들
그 외 주요 체내동태 평가 파라미터들로서는 AUC값에 농도적 개념의 모멘트를 한 번 더 곱하여 구하는 AUMC(area under the moment curve), 평균체류시간 (mean resident time, MRT), 소실속도상수(elimination rate constant, k), 흡수속도상수 등이 있다. 이상의 주요 체내동태 파라미터를 정리할 수 있다.
2.9 신약개발을 위한 체내동태 파라미터의 응용
약물의 체내동태를 파악하기 위하여 구하는 다양한 파라미터들은 각 약물들이 지닌 고유의 성질을 지닌 값이라고 할 수 있다. 하지만 이러한 체내동태 파라미터들은 대부분 혈중농도-시간 곡선을 통하여 계산되어지는 값이므로 어떻게 시간 설정을 하느냐 혹은 약물농도 분석을 얼마나 정확하게 하느냐에 따라서 값이 변할 수 있다. 따라서 신약의 체내통태 평가를 위하여 어떻게 체내동태 평가 시험을 진행하느냐는 중요한 부분일 수 있으며 현재 알려진 체내동태 평가를 위하여 다음의 사항들을 지키면 좋다고 알려져 있다.
마지막 샘플링 시간(terminal time point)까지의 AUC값(AUCt)이 외삽하여 얻어지는 무한 시간까지의 AUC값(AUC∞)의 80%를 넘어야 한다. 즉, 무한시간까지의 예측값들이 어느 정도 의미 있는 값을 가지기 위해서는 적절한 시간까지 샘플링 하는 것이 중요하다.
마지막 샘플링 시간이 적어도 반감기(t1/2)의 3-4배를 넘어야 한다. 반감기는 약물의 체내 잔존량에 관여하는 파라미터이므로 3 배 (87.5% 소실 가정) 혹은 4배 (93.75% 소실 가정) 이상이 되어야 대부분의 약물이 체내에서 사라진 것으로 예측되어 더 이상의 체내동태 변화가 일어나지 않을 것으로 예상할 수 있다. 때로는 보다 엄격하게 게 7배(99% 이상 소실 가정)까지의 시간동안 샘플링 하는것이 필요할 수도 있다.
혈중농도-시간 곡선의 세로축의 혈중농도를 로그스케일(log scale)로 그렸을 때 직선형태의 구간이 몇 개로 보이느냐에 따라서 체내동태 해석에 있어서 구획 모델(compartment model) 분석에서 한 구획, 두 구획 혹은 다구획 모델로 나눌 수 있다. 이때 선형 구간의 생플링 시간 포인트가 3 포인트 이상 되어야 보다 정확한 값을 구할 수 있다.
특히, 마지막 소실상 (terrninal phase) 에서의 마지막 3 포인트가 선형성을 보이는 것이 중요하다. 왜냐하면 이 마지막 소실상에서의 기울기가 체내동태 파라미터 반감기 (t1/2) 계산에 결정적이기 때문이다. 정맥투여의 경우 초기 혈중농도 3 포인트의 농도와 선형성도 중요하다. 왜냐하면 이 초기의 혈중농도를 외삽하여 가상적인 제로 시간의 혈중농도(Co)를 구하고 이 값에 의해서 분포용적 (Vd)이 계산되어지기 때문이다.
정맥투여의 경우는 필요에 따라서 위의 조건을 모두 만족할 수 있다면 3-4 포인트로도 체내동태를 파악할 수 있으나, 경구투여의 경우는 Tmax를 중심으로 Tmax에 도달 할 때 까지(흡수 구간) 3 포인트 이상, 마지막 소실구간(terrninal phase) 에서의 3 포인트 이상, 그리고 Tmax 중심으로 3 포인트를 포함하고 있어야하기 때문에 적어도 7-8포인트 이상 필요한 경우가 대부분이다.
샘플링 시간 포인트의 전체 개수는 필요한 샘플링 시간과 그 때 채취하는 실험동물의 소실 혈액의 부피에 따른 생리학적 변화요인을 감안하여 복합적으로 정하여야 한다. 체내동태 해석에 있어서 정확한 혈중농도 분석은 매우 중요하며 필요에 따라서 약물의 분석 밸리데이션(validation) 이 필요한 경우도 있다. 특히, 고농도와 저농도의 혈중농도 분석에 있어서의 문제가 체내동태 파라미터 해석 에 영향을 줄 수 있다. 예를 들면, 소실상에서의 혈중농도는 보통 매우 낮은 농도이기 때문에 분석기기의 감도 등에 영향을 크게 받고 따라서 체내동태 해석에 있어서 정량분석상의 오류로 인하여 소실상의 혈중농 예전보다 엄격한 규제를 요구하고 있다.
따라서 제약회사와 같은 개발자 측면에서도 신약후보물질들이 좋은체내동태 프로파일을 갖는 물질들을 개발하는 것이 추후 임상과정에서의 실패율을 줄이고 회사의 이익구조를 높이는 데 유리하다고 판단하고 있다. 실제로 다국적 제약회사들을 중심으로 1990년대 이후 신약개발 초기에 체내동태 특성을 파악하고 보다 좋은 체내동태 양상을 보이는 물질들을 후보물질로 도출하고자 하는 노력이 활발히 진행되고 있다. 표 7.4는 신약개발을 위한 일반적인 체내동태 파라미터 평가 기준의 예시를 든 것이다.
이런 다양한 이유로 다국적 제약회사를 중심으로 하는 신약후보물질들의 초기 체내동태 평가 연구는 2000년대 들어와서 더욱 활발해 지고 있으며 신약개발 초기부터 약효검색과 더불어 체내동태 및 in vitro 독성 등을 전략적 단계에 맞게 초기에 동시 검색을 하기도 한다. 따라서 최근 FDA로부터 신약허가를 받는 신약은 과거에 사용해 왔던 약물들보다 약효 독성적 측면뿐만 아니라 체내동태적으로도 좋은 물질들이 많이 개발되고 있다. 예를 들면 sitagliptin (Januvia, Merck & Co.) 같은 경우도 dipeptidyl peptidase-4 (DPP-4) 저해제로서 새로운 제 2형 당뇨치료제로서 개발되었는데 (2006년 10월 FDA 허가) 양호한 체내동태 양상을 보임을 알 수 있다.
신약개발 초기단계에서 가장 중요한 단계 중 하나인 선도물질 최적화 과정 (hit-to-Iead optimization)에서는 다음과 같은 체내동태 및 독성의 기준을 최소한으로 갖추는 것이 좋다고 알려져 있다. (1) 경구생체이용률(BA,%F)는 30%를 최소한 넘어야 하고, (2) 클리어런스(CL)는 rat의 경우 30 ml/min/kg 보다 작아야 하며, (3) 0 ≤ log D7.4 ≤ 3, (4) CYP450 isozyme 저해정도는 낮아야 하며, (5) 혈장단백결합율은 99.5% 보디는 작아야 하며, (6) 치료영역에서 급성 독성 및 만성 독성은 없어야하며, (7) 5-10 배의 치료영역에서도 유전독성, 기형독성 및 발암성은 없는 것이 좋다.
하지만, 이러한 기준은 철대적인 것이 될 수 없고 각 개발자들이 각각의 상황에 맞게 신약후보물질들을 평가하고 개발 단계 진행을 취하여 약효, 독성, 체내동태 등의 조기 검색을 통하여 종합적으로 판단하는 신약개발 추진전략을 쓰는 것이 바람직할 것이다.
3. 신약개발을 위한 체내동태 평가 및 최적화과정
3.1 약물의 흡수 과정 및 평가법
일반적으로 투여되는 약물의 대표적인 경로는 정맥투여와 경구투여이며 정맥투여일 경우 바로 전신순환계로 도달하기 때문에 흡수과정이 따로 존재하지 않는다. 하지만 경구투여일 경우 약물이 전신순환계에 도달하여 약효를 나타내기까지는 몇 가지 연속적인 과정들을 거치게 되며 그 과정을 약물의 흡수과정이라고 부른다. 약물이 위장관에서 흡수되기 위해서는 액상이면 용해과정이 필요가 없으나 대부분의 경구치료제의 경우 고형 상태이며 이러한 고형의 약물이 위장관에서 액상으로 용해되어야 홉수가 가능하게 된다.
이러한 용해과정은 약물의 용해도와 직접적인 관계가 있으며 또한 약물의 고유 pKa값과 위장관의 pH에 따른 용해도에 영향을 받는다. 용해된 약물은 주로 위장관 상피세포를 통해서 세포막을 통과하여 간으로 유입되는 간문맥 혈류시스템에 도달하게 된다. 용해된 약물의 상피세포막투과는 약물의 친지질도 및 세포투과도에 영향을 받으며 간문맥 혈류시스템에 의해서 간으로 유입된 약물은 간에서 바로 대사작용을 받게되는 간초회통과효과(hepatic first-pass effect) 과정을 거치게 된 후 비로서 전신순환계에 도달하게 된다.
이를 종합해보면, 약물의 흡수단계에서는 약물의 흡수정도는 고유한 물리화학적 특성(용해도, pKa, log P/log D 등)과 함께 생체의 생리학적 환경(pH, 소화관 운동성, 소화관 혈관분포, 위장관 상피세포의 약물수송체 등)의 복합적 함수에 의해서 결정된다. 특히, 약물의 용해도, 소장상피세포막투과도 및 간초회통과효과에 약물의 흡수 과정은 대부분 결정되게 된다. 경구투여 약물의 흡수정도는 흡수속도상수와 생체이용률과 같은 체내동태 파라미터로부터 예측할 수 있으며 생체이용률이 낮은 약물은 약물의 용해도가 낮아서 용액상태가 잘 되지 못하거나, 세포막투과도가 낮아서 전신순환으로의 흡수가 불량하거나, 소장상피세포막을 투과한 이후 전신순환으로 도달하기 전에 간대사(초회통과효과)를 크게 받을 가능성이 높다. 동일한 약물성분일지라도 제형(예, 정제와 캅셀제, 정제와 액상제제 등)이 다르면 두 제형 간에는 흡수율이 다를 수 있기 때문에 전신순환계에서의 혈중농도 곡선의 양상도 다르게 나타날 수 있다. 약물의 흡수단계 평가는 이러한 다양한 요소들을 평가하고 체내동태를 프로파일링하기 위해서 필요하다.
약물의 용해과정을 평가하기 위해서는 약물의 용해도, 이온화상수(pKa), 친지질도(log P/log D)와 같은 물성 값(physicochemical property)을 측정하고 정제 및 캅셀제와 같은 고형제제는 붕해시험 (disintegration test)을 통해서 용해정도 및 용해속도를 예측할 수 있다. 약물의 소장상피세포막투과 정도를 평가하기 위해서는 인공막투과도 시험 (Parallel artificial membrane permeability assay: PAMPA)와 세포막투과도 시험 (cell permeability test) 등을 통하여 세포막투과도를 예측할 수 있다.
가장 많이 사용되는 세포막투과도를 위한 세포주는 인간대장세포에서 유래한 Caco-2 세포주이며 신약개발을 위해서는 간단하게 Madin-Darby Canine Kidney Epithelial Cells (MDCK Line) 혹은 LLC-PK(pig kidney epithelial cell line)와 같은 세포주에서의 세포막투과도 측정도 널리 이용되고 있다. 이러한 세포막투과도 측정을 위한 세포주들의 특징은 소장상피세포의 폐쇄막(tight junction)과 비슷하게 세포간의 공극이 적은 단일세포층으로 이루어져 있어서 세포막투과도 측정이 용이하다.
3.2 약물의 분포 과정 및 평가법
흡수과정을 거친 약물은 전신순환계를 통하여 다양한 체내 장기 및 조직으로 분포하는 과정을 거치게 된다. 이러한 약물의 분포 양상은 다양한 체내 조직과 체액에서의 약물 농도의 변화로 확인해 볼 수 있다. 약물의 분포에 영향을 미치는 생리학적인 요인은 여러가지가 있으나 (1) 장기 및 조직으로의 혈류량 (2) 약물의 단백결합 (3) 약물의 지용성과 세포투과도에 의한 조직으로의 분포 차이 (4) 다양한 조직에 서로 다르게 분포하고 있는 약물수송체 등이 주요하게 영향을 미치는 것으로 알려져 있다.
우선 약물분포를 이해하기 위해서는, 다른 장기 및 조직들간의 혈액의 관류속도 차이가 존재함을 이해하여야 한다. 예를 들어, 심장, 간, 폐, 신장 등과 같은 장기의 조직은 빠른 혈류속도를 보이는 조직이며 반면 지방과 뼈와 같은 조직은 낮은 혈류속도를 보이는 부위이다. 약물 분포에서 혈류속도가 중요한 이유는 전신순환계에서 특정 조직으로의 분포 속도는 이러한 혈류속도에 의존적이기 때문이다. 만약 혈류속도가 증가하게 된다면 조직으로의 약물분포는 증가한다. 따라서 일반적으로 약물들은 혈류속도가 빠른 조직에 더 빠르게 분포하는 양상을 보인다. 약물이 조직으로의 분포 이후 조직 중 약물농도는 조직으로 들어가는 약물의 양과 나오는 양이 같아져 평형을 이를 때까지 증가하며 이러한 평형을 이룬 상태에 도달하는 속도와 시간에 있어서 혈류속도의 차이가 결정적인 역할을 하게 된다. 약물의 조직분포는 특정 시간 혹은 시간에 따른 조직 중 농도를 측정하여 평가한다.
약물의 분포에 영향을 미치는 또 다른 중요한 요인은 약물의 조직 중 단백질과의 결합 정도 및 전신순환계에서의 혈액 중 단백질들과의 결합 정도이다. 특히, 혈장에서의 단백결합은 약효의 발현은 혈장단백들과 해리상태의 약물들만 관여한다고 알려져 있다. 따라서 약물이 조직에 분포하고 약효를 나타내기 위해서는 혈장단백질들과 가역적 반응속도와 단백결합율이 중요한 요인이 될 수 있다. 혈장단백결합율이 높은 약물들은 다른 높은 단백결합율을 가지는 약물들과 상호작용을 일으킬 수도 있다.
특히 단백결합율이 높고 좁은 치료영역을 가지는 약물들은 자유 혈장 농도를 구하여 체내동태를 파악하는 것이 약효와 독성을 모니터링 하는데 더 효율적일 수 있다. 약물의 단백결합율 측정을 위해서 평형투석법(equilibrium dialysis method)을 이용하여 단백질과 결합하고 있는 약물과 유리형 약물 비율을 측정하여 그 값을 구하고 평가한다. 평형투석법에 의한 혈장단백결합율은 다음과 같은 식을 통하여 구할 수 있다.

현재 시판중인 약물들의 혈장단백결합율은 대부분 90% 이상의 높은 값을 보인다. 즉, 혈장단백은 수용성의 혈류시스템에서 많은 약물들의 전달매개체로 이용되지만 이로 인한 다른 치료 영역이 좁으면서 혈장단백결합율이 높은 약물들과의 약물상호작용 및 비결합형 약물의 조직분포에 따른 약효발현 등의 문제는 신약개발 단계 초기부터 고려를 하는 것이 바람직하다.
3.3 약물의 대사 과정 및 평가법
약물의 대사작용은 대사효소를 포함하고 있는 여러가지 장기에서 일어날 수 있으나 주로 약물대사효소가 분포하고 있는 간에서의 대사작용이 주를 이룬다. 대사작용(생체내변화)은 투여된 약물이 다른 물질로 구조적으로 전환되는 과정이다. 약물은 체내에서 생체이물질(xenobiotics)로 인식하고 대사작용에 의해서 투여한 모약물보다 수용성이 높아져서 더 빠르게 체내에서 제거되는 해독(detoxification) 과정의 개념을 포함하고 있다. 때로는 약물은 대사에 의해서 본래의 약물보다 더 약효를 가지는 활성형 대사체를 가질 수 있으나 대개의 경우 불활성형의 대사체 형태로 체외로 배설되는 경우가 일반적이다.
이러한 활성형 대사체의 경우 모약물은 전구약물(pro-drug) 형태로 고려되며 모약물 뿐만 아니라 활성형 대사체의 체내동태 양상도 파악해야만 한다. 간은 여러가지 대사효소를 포함하고 있으며 이는 대사반응의 양식에 따라 1상의 생체내 변화반응과 2상의 포합반응으로 나뉘게 된다. 이러한 간대사효소의 평가방법으로는 간마이크로좀(liver microsome) 또는 간세포(hepatocyte)를 이용한 in vitro 대사안정성 시험으로 간대사반응 정도를 예측할 수 있다. 대표적인 간마이크로좀 반응 양식이 있다. 필요에 따라 이러한 in vitro 대사반응 반감기로부터 in vivo에서의 간 고유 클리어런스(CL intrinsic, hepatic) 값을 예측할 수도 있다.
또 다른 사람 체내동태 예측법으로는 약물의 분포에 있어서 생리학적 요인을 감안한 방법이 있을 수 있다. 여기에는 각 장기에서의 혈류속도, 장기 크기, 조직과 체액의 부피, 혈액-혈장 및 조직-혈장 약물농도비율, 단백결합률, 대사효소의 활성도 등이 복합적으로 작용할 수 있다. 이 방법은 주로 사람의 in vltro 실험결과로부터 in vivo 체내동태 파라미터를 예측하는데 이용될 수 있다.
일반적으로 약물 혹은 신약후보물질의 대사안정성 시험은 일정 시간에서의 % 잔류량을 통한 안정성 또는 반감기를 구하여 그 정도를 평가하나 다른 동물들간의 용량 비교와 변환을 위해서는 간에서의 클리어런스를 구하여 비교하는 것이 체내동태를 좀 더 사실적으로 반영한다고 할 수 있다. 간에서의 클리어런스를 예측하는 방법으로 in vitro 마이크로좀에서의 안정성시험을 통하여 얻은 약물의 반감기 값을 통하여 in vitro에서의 고유를리어런스(CL intrinsic, in vitro) 값을 구하고 이를 통하여 in vivo에서의 간고유클리어런스(CL intrinsic, hepatic) 값을 예측할 수 있으며 이 때 다음의 관계식을 이용한다. 간고유클리어런스(CL intrinsic, hepatic) 값을 예측하기 위한 변환 계수값으로는 단위 간무게당 마이크로좀의 양(mg microsomal protein per gram liver, MPPGL = 45 mg microsomal protein/g liver)과 간무게(1500g liver/70kg body weight, human)가 있으며 이는 이미 알려진 값을 이용해서 계산할 수 있다.
간고유클리어런스는 생체에서의 체내동태를 이해하는데 유용한 파라미터이다. 하지만 CYP을 통한 대사이외의 다른 작용도 있음을 주지해야 한다. 이러한 고유클리어런스(intrinsic clearance)는 in vivo 에서 생리학적 의미를 갖는 개념으로 해석이 필요하며 간고유클리어런스를 해석하는데 있어서 가장 중요하게 취급되고 있는 파라미터는 간혈류량(QH, hepatic blood flow)이다. 일반적으로 알려진 “well-stirred" 모델을 이용하면 장기내에서의 약물분포는 매우 신속하게 일어난다고 가정하고 간혈중농도와 간 내에서의 비결합형 약물농도는 똑같다고 가정하면 다음과 같은 식으로 나타낼 수 있다.
일반적으로 사람의 경우 간혈류량이 21 (ml/min/kg)으로 알려져 있는데, 만약 간고유클리어런스가 간혈류량에 비해서 매우 높은 약물이라면(즉, CLH,int >> QH), 위의 식은 CLH = QH 과 같이 표현할 수 있으며 이는 간고유클리어런스가 높은 약물은 간혈류량에 의해서 간클리어런스가 결정된다고 할 수 있다.
따라서 대사에 관여하는 대사효소의 발현정도나 혈장단백에 비결합형 비율이 증가하여도 간혈류속도에 비해서 영향을 덜 받는다고 할 수 있다. 반대로 간혈류량이 간대사고유클리어런스값보다 훨씬 크다면 (즉, QH >> CLH.int) 위 식은 CLH = CLH,int과 같이 표현할 수 있으며 이러한 약물은 대사효소에 의한 간고유클리어런스 값과 혈장단백 비결합형 약물 분율이 간클리어런스 값에 지배적으로 영향을 주게 되며 궁극적으로는 전신 체내동태에도 영향을 미칠 수 있다. 따라서 이러한 경우에 해당하는 약물들은 약물대사효소 및 혈장단백과의 약물상호작용 부분에 대해서 더욱 주의를 해야 한다.
3.4 약물의 배설 과정 및 평가법
약물이 체내로부터 제거되는 두 가지 주요 방식은 대사와 배설 과정이다. 이를 합하여 약물의 소실 과정이라고 부른다. 간은 주로 대사과정으로 약물을 소실시키는 부위이며 신장은 뇨배설 (urinary excretion)을 통해서 약물을 배설시키는 장기이다. 지용성이 높은 약물들은 담관배설 (biliary excretion)의 형태로 담즙과 함께 담관으로 배설되며 이렇게 담관으로 배설된 약물들은 변으로 배출되거나 장간순환(entero-hepatic circulation)의 형태로 “간-담관배설-소장-재홉수-간”을 순환하며 전신순계에 오래 머물기도 한다. 많은 약물과 그들의 대사의 가장 중요한 배설 경로는 뇨배설과 담관배설이다.
신장에서의 약물 배설을 결정짓는 클리어런스 값은 여과, 능동수송에 의한 분비, 재홉수 등에 영향을 받기 때문에 복잡한 반응 양식이다. 체내동태 파라미터에 의한 신장배설은 뇨로 배설된 총 약물양을 AUC 값으로 나누어서 신장클리어런스 값을 구할 수 있다. 체내에서의 총 클리어런스 값은 배설경로에 따라 신장클리어런스와 담관클리어런스 및 기타 클리어런스의 총합이 된다.
3.5 신약의 체내동태 개선을 위한 최적화 과정
신약으로서 유효한 약효를 극대화하고 독성을 최소화 하려면 필요에 따라 특정 혹은 전체적인 체내동태 양상의 개선을 위해 최적화( optimization) 과정을 거칠 필요가 있다. 일반적인 신약후보물질 체내동태 평가에 있어서 흔히 만나는 문제는 높은 클리어런스(CL)값과 낮은 경구 생체이용률이다. 궁극적으로는 동물실험을 통해서 체내동태 결과를 얻어야 하지만 최적화 과정 동안 재합성된 많은 후보물질들을 모두 in vivo 체내동태 평가를 히는 것은 현실적으로 힘들 수 있다. 이러한 체내동태 문제의 근본적인 원인이 무엇인지를 찾아 그 부분의 개선과 최적화 연구를 먼저 진행함이 바람직하다. 정맥투여 후의 높은 클리어런스(CL) 문제는 (1) 높은 간대사 - Phase 1 혹은 Phase II 대사반응 (2) 높은 간담즙배설 (hepato-biliary excretion) - 능동 약물수송체 관여 여부 파악 (3) 높은 신장배설 (4) 낮은 혈액에서의 안정성 등에서 문제가 있어서 전신혈류계에서의 소실이 빨리 나타날 수 있다.
낮은 경구 생체이용률이 가지는 문제는 (1) 높은 간이나 소장에서의 초회통과효과 (first-pass effect) (2) 높은 간담즙배설 (hepato-biliary excretion) (3) 장에서의 낮은 용해도 - 가상 위장관액에서 의 용해도. [예, simulated gas띠c tlu id(SGF), simulated intestinal tluid(SIF), fasted state simulated intestinal fluid (FaSSIF), fed state simulated intestinal fluid (FeSSIF), simulated intestinal bile salts-lecithin mixture (SIBLM), pH 1- 8 buffer에서의 용해도 테스트] (4) 낮은 장관투과도-(PAMPA), Caco-2 A→B와 B→A 수송시험, MDCK 투과도, P-gp를 비롯한 efflux pump 기질여부, 장에서의 효소 또는 pH에 따른 분해 등의 이유에 기인할 수 있으며 각 원인에 따른 최적화 작업을 수행해야 한다. 각 in vitro 체내동태 파라미터와 in vivo 체내동태 파라미터 간의 상관관계를 나타낼 수 있다.
신약후보물질의 체내동태를 최적화 과정으로 대체로 대사안정성을 높이는 방법, 혈장에서의 안정성을 높이는 방법, 세포투과도를 높이는 방법 퉁이 주로 이용되고 경구투여 신약개발의 경우 궁극적으로는 생체시스템에 투여되었을 때 생체이용률을 높이기 위한 방법도 시도된다. 이러한 대사안정성, 혈장안정성이 나쁜 후보물질들을 구조 변경을 통하여 개선한 예와 이렇게 대사안정성 개선을 통하여 궁극적으로 경구 생체이용률과 같은 체내동태 개선을 위하여 구조적 변경을 통한 최적화 과정의 예를 보여준다.
이렇게 In vitro 체내동태 평가를 효율적으로 함으로써 정맥투여 혹은 경구투여에서의 in vivo 체내동태 개선을 신속히 할 수 있으며 또한 필요에 따라서는 약물의 독성과해독작용을 개선하기 위한 최적화 과정도 필요할 수 있다. 신약개발과정 중에는 약효 시험과 더불어서 독성 및 체내동태 시험도 동시에 해서 모두 좋은 성질을 가지는 후보물질을 가지는 최적화 과정을 거치게 된다. 이 최적화 과정에서는 필요에 따라서 후보물질의 구조적 수식을 통해서 구조변경 및 재합성을 통해서 계속 최적화 후보물질을 찾아가는 과정이 수반된다.
3.6 고효율 체내동태 평가법
신약개발과정 중에서 체내동태 최적화를 위해서는 이러한 후보물질들의 구조수식과 재합성을 통해서 많은 새로운 후보물질들을 만들게 된다. 이렇게 많은 후보물질들을 단기간 내에 ADME/PK 스크리닝을 하여 후보물질들의 신약개발 진행단계를 결정하는 것은 신약개발 기간을 줄이고 비용적 측면에서의 효율성을 높이기 위해서 중요하다. 따라서 이렇게 많은 물질들을 보다 적은 비용으로 빨리 정확하게 ADME/PK 스크리닝을 하는 것이 제약산업적 측면에서는 중요하며 많은 샘플들을 빨리 분석하기 위해서 여러가지 고효율 스크리닝 (high-throughput screening, HTS) 기법 이 ADME/PK 스크리닝을 위해서 이용되고 있다. 예를 들면, 96-well plate 혹은 384-well plate 기반에서 실험을 진행하여 다양한 multichannel pipette이나 automated liquid handling robot을 이용하여 자동화된 실험진행을 할 수도 있다.
Automated liquid handler를 이용한 대사안정성 시험 이나 in vivo 체내동태 혈액샘플 전처리 및 분석을 위한 자동분석법의 예시도 있다. 또한 체내동태 해석을 위해서는 약물농도분석이 매우 중요한 데 LC-MS/MS 시스템의 발전을 통하여 낮은 농도의 혈액 중 약물농도 분석을 보다 편하게 빠르게 분석할 수 있게 됨으로써 체내동태 평가 실험은 훨씬 가속도가 붙게 되었다. 최근에는 동물로부터 혈액을 자동으로 채혈해주는 자동채혈기(Culex ABS 시스템 등의 등장으로 실험동물의 스트레스와 채혈시의 부담이 줄어들게 되었다.
이러한 기기적 도움 외에도 in vivo 체내동태 시험에 있어서 신약개발 초기 단계에서는 보다 빠른 스크리닝을 위해서 다음과 같은 다양한 방법을 도입할 수도 있다. N-in-1 (cassette or cocktail) 투여법과 같이 여러 개의 후보물질들을 섞어서 동시에 투여하여 체내동태를 동시에 해석하거나 투여는 각각 한 후 시료를 혼합하여 분석만 함께 하는 방법 혹은 모든 시간포인트의 시료를 혼합하여 AUC를 예측하는 방법 등이 사용될 수도 있다.
4. 체내동태에 영향을 미치는 생리학적 인자
4.1 체내동태에 영향을 미치는 체내 단백질
약물의 흡수, 분포, 대사, 배설 과정 및 체내동태에 영향을 미치는 요인은 여러 가지가 있다. 우선 약물의 고유한 물성(용해도, 이온화도, 친지질도 등)과 신약의 다양한 제형적 요인(부형제, 투여제형의 생산을 위한 약제학적 과정 등)이 있을 수 있으며, 다양한 투여경로 (정맥투여, 경구투여, 경피흡수 등)를 통해서 흡수, 분포, 대사, 배설과 같은 일련의 과정을 거치는 동안 많은 생리학적 요인에 의해 영향을 받는다.
그 중 가장 대표적이면서 중요한 것은 생체 내에 존재하는 다양한 단백질과 반응하여 나타나는 신약의 체내동태 양상이다. 체내동태에 영향을 미칠 수 있는 생체내 단백질로서 대표적인 것들은 약물대사효소, 약물수송체, 혈장단백 등이 있다. 약물 수용체의 경우 체내동태에는 직접적인 영향이 없으나 약효 및 독성 발현과는 밀접한 관계가 있다. 신약이 체내 단백질과 반응하는 양식은 일반적으로 알려져 있는 것과 같이 기질 특이성에 따른 경쟁적 길합 반응 및 포화상태에 이르면 반웅속도가 더 이상 증가하지 않는 현상 등이 나타날 수 있다.
이러한 이유로 체내통태에 영향을 미치는 생체내 단백질인 약물대사효소, 약물수송체 및 혈장단백과 약물의 결합반응 여부를 파악하는 것은 효과적인 체내동태를 알아보기 위해 매우 중요하다고 할 수 있다. 특히, 약물의 사용에 있어서 생체내 단백질이 중요한 이유는 두 가지 이상의 복합 역물을 투여할 경우 동일 단백질을 대상으로 경쟁적 결합을 하거나 용량에 따른 포화현상이 일어나서 투여 약물의 체내동태 양상이 확연히 달라져서 독성에 노출되거나 약효발현이 차이가 날 수 있기 때문이다.
최근의 분자생물학을 바탕으로 하는 기초 생물학의 발전으로 이러한 생체내 단백질의 역할 규명과 스크리닝 방법이 급속한 속도로 발전해 왔다. 예전에는 혈중 농도곡선 및 광범위의 대사 및 체내동태 양상을 파악할 수 있었다면 최근에는 체내동태 양상을 설명하기 위한 구체적인 부분까지의 스크리닝과 연구가 가능해졌으며, 이러한 연구는 신약의 허기를 위해서도 요구하는 경우가 많아지고 있다.
4.2 약물대사효소 (Drug metabolic enzyme)
일반적으로 신약의 체내동태에 가장 영향을 많이 끼치는 것은 약물의 대사반응이며 이에 관여하는 약물대사효소에 대한 이해는 체내동태 해석에 있어서 광범위하게 중요하다고 할 수 있다. 약물대사반응양식에 따라 산화, 환원, 가수분해 등의 반응으로 약물의 구조중에 극성이 높은 관능기가 도입되는 1상 대사반응과 글루크론산 (glucuronic acid), 황산, 아미노산 같은 생체성분이 결합하는 포합반응으로 대사약물을 더욱 빨리 배설되기 쉬운 형태로 바꾸는 2상 대사반응이 있다. 대표적인 약물 대사반응 양식과 이에 관여하는 약물대사효소를 알수 있다.
이중 약물 대사에 가장 중요하게 인식되고 있는 것은 Cytochrome P450 (CYP450) 계의 대사효소이다. 약물대사에 관여하는 주요 CYP450 대사효소와 그 비율을 알 수 있으며, 이 중 주요 CYP450에 대한 저해반응 정도는 신약의 개발에서 중요하게 취급되고 있다. 약물대사효소 반응은 크게 기질반응, 저해반응, 유도반응의 세 가지로 나눌 수 있으며 대표적인 약물대사효소인 CYP450 에 대한 3가지 반응 양식을 나타낼 수 있다.
4.3 약물수송체 (Drug transporter)
약물이 생체내에서 흡수, 분포, 대사, 배설 과정을 거치는 동안 다양한 조직세포막을 통과하게 되는데, 주로 세포막에 존재하여 약물의 수송에 관여하는 단백질을 약물수송체라고 부른다. 약물수송체가 체내동태 해석에 있어서 중요한 이유는 대사를 제외한 흡수, 분포, 배설의 과정들은 주로 약물수송 자체에 의해서 영향을 받 기 때문이다. 약물의 수송에는 약물수송체가 관여하지 않고 약물이 세포막을 단순투과하는 수동수송(passive transport)과 특정 약물수송체가 직접적으로 관여하는 매개수송 (carrier transport)으로 나눌 수 있다.
주요 약물수송체를 분류하면 ATP 에너지를 시용하여 농도구배에 역행해서 능동적으로 수송할 수 있는 ABC 약물수송
체 (ATP-binding cassette transporter)와 나트륨 등의 매개물질을 이용하여 수송되는 SLC 약물수송체 (solute carrier transporter)로 나눌 수 있다. 약물수송체는 체내 조직에 따라 아주 다양한 종류가 분포하고 있으며 신약이 약물수송체를 경유하게 되면 이러한 약물수송체를 매개로 복잡한 체내동태양식이 일어날 수 있다 특히, 약효 타깃 조직에서의 약물수송체 관련 여부는 타깃조직에서의 약물농도와 약효발현에 직접적인 영향을 줄 수도 있는 것으로 알려져 있다.
4.4 혈장단백 (Plasma protein)
약물의 혈장단백질과의 결합여부는 약물의 분포와 체내동태에 영향을 준다. 그리고 자유 해리형 약물들만이 약효의 직접적인 발현과 관련이 있다고 알려져 있으므로 신약의 체내동태와 약효발현을 해석하는데 있어서 전반적으로 중요한 요인이다. 또한 단백결합율이 높고 좁은 치료영역을 가지는 약물들은 다른 높은 단백결합율을 가지는 약물들과 상호작용을 일으켜 독성을 나타낼 가능성 이 높으므로 혈장단백결합율과 결합력을 측정하여 유리형 약물의 비율을 조절하는
것이 필요할 수 있다.
대표적인 혈장단백으로는 혈장 알부민(human serum albumin: HSA)과 α1-acid glycoprotein (AGP), lipoprotein 등이 있다. 이들 중 양적으로 가장 많고 약물과 잘 결합하는 단백질은 알부민이다. 대체로 산성 및 중성을 띄는 대부분의 지용성 약물들이 알부민과 결합을 하고 약물의 성질이 염기성에 가깝다면 a1-acid glycoprotein 에 보다 더 강하게 결합할 수 있다. 약물과 이들 단백질과의 결합은 대체로 가역적이며 생체 내에서의 평형상태와 밀접한 관계가 있으며 유리된 약물이 소실되어 혈중농도가 낮아지면 새로이 유리형 약물이 생길 수 있다. 이러한 결합과 해리에 걸리는 시간은 0 .02초 정도로 매우 빨리 평형상태를 유지할 수 있는 것으로 알려져 있다.
4.5 약물상호작용 (Drug-drug interaction)
약물상호작용이란 두 가지 이상의 약물을 동시에 사용하였을 때 그 비슷한 성질로 인하여 일어날 수 있는 약효와 독성 및 체 내동태와 같은 작용에 있어서 서로 저해 및 유도반응으로 인한 상호작용을 뜻한다. 이러한 약물상호작용은 약물의 고유적인 물성이나 성질에서 기인하는 경우도 있겠지만 대부분 생체내의 단백질을 공유하기 때문에 일어나는 현상이다. 서로 다른 두 가지 이상의 약물이 체내동태에 영향을 직접적으로 주는 약물대사효소, 약물수송체, 혈장단백 등과 상호작용을 일으켜 체내동태가 변하는 경우와 체내동태에는 큰 변화가 없으나 동일 약물수용체를 놓고 서로 상호작용을 일으켜서 약효 반응이 변하는 경우도 존재할 수 있다.
체내동태적 개념에서의 약물상호작용은 특정 두 가지 이상의 약물을 같이 사용하였을 경우, 여러가지 생체내의 단백질들 (약물대사효소, 약물수송체, 혈장단백 등)과 반응 양상이 변하고 약물의 혈중농도 프로파일이 달라져서 약효 또는 독성 발현이 달라지는 현상이라고 규정할 수 있다.
CYP3A4 대사효소에 의한 약물상호작용을 보여주는 예시로서 고지혈증치료제인 pravastatin을 CYP3A4 저해제인 itraconazole과 병용투여시 그 혈중농도곡선 및 AUC와 Cmax 같은 체내동태 파라미터가 변하는 결과를 나타내는 것을 알 수 있다. 이렇게 CYP 저해작용을 가지는 약물과 그 대사효소에 의해서 대사 및 체내동태의 영향을 받는 약물을 병용 투여할 시에는 주의해서 사용해야 한다. 이미 기존에 시판 중인 많은 상용 약물들이 CYP 대사효소에 의해서 대사작용을 받는 것으로 알려져 있다.
따라서 신약개발 후보물질의 평가에 있어서는 만약 후보물질이 CYP 저해작용을 보인다면 그 자체로 개발을 중단할 필연적 이유는 없으나 추후 처방 및 사용에 있어서 여러가지 제약이 따르게 되고 그 상품개발가치성이 줄어들게 되므로 최근의 신약개발 경향은 가능하면 신약개발 초기단계에서 대사효소 및 약물수송체와의 약물상호작용 여부를 파악하여 계속 개발 진행여부를 판단하려고 노력하고 있다. FDA에서는 이러한 약물대사효소와 약물수송체에 의한 약물상호작용을 검토하기 위해서 가이드라인을 발표하고 신약개발 허가 전에 자료를 제출할 것을 의무로 하고 있다.
4.6 약물의 용량의존성 (Dose-dependency)
생체내 단백질 농도에 따른 포화현상은 투여 약물의 용량에 따라 다른 체내동태 프로파일을 보이는 직접적인 원인이 될 수 있다. 신약의 용량에 따른 체내동태 포화여부를 관찰하는 용량의존성시험은 약물 투여시 예상되는 정상적인 혈중농도 범위를 벗어나게 되었을 경우 독성이 발현되거나 약효에 문제가 생길 가능성을 확인하기 위해 실시한다. 용량의존성의 여부는 확인하고자 하는 용량범위 내 여러 농도에서 구한 체내동태 파라미터 중 정맥투여 후 얻어지는 클리어런스(CL)값이나 경구투여 AUC를 용량으로 나눈 값(AUC/dose, dose-normalized AUC)을 비교하여 판단한다.
4.7 체내동태에 영향을 미치는 약물유전체 (pharmacogenomics)으| 의미와 역할
약물유전체학이란 약물반응의 차이를 유발하는 유전적변이를 연구하는 학문을 의미한다. 일반적으로 질병의 발생에 관여하는 유전자의 SNP(single nucleotide polymorphism)와 같은 유전적 변이에 따른 질병의 발생여부와 정도 및 일배체형 (haplotype) 분석과 나아가서는 유전자 발현 조절 및 발현 양상에 대한 연구를 포함하며, 약동력학의 경우 약물농도와 반응에 영향을 미칠 수 있는 유전자에 관한 연구를 중점으로 한다.
따라서 체내동태에 영향을 미치는 약물대사효소 및 약물수송체에 대한 유전자변이와 그 기능 연구를 많이 진행하며 환자 개개인에 따른 혈중농도 및 체내동태의 차이와 또 이에 따른 약효 및 독성 발현 정도의 차이가 약물대사효소 및 약물수송체 등의 유전적 변이에 따른 기능의 변화 때문인 경우가 많다. 개개인에게 맞는 최적의 맞춤치료를 위해서 개인별 혈중농도와 체내동태 양상을 파악하고 그에 맞는 가장 적절한 용량과 약물치료요법을 제공하는 것이 환자별 맞춤의약치료의 근간을 이룬다고 할 수 있다.
현재 알려져 있는 체내동태에 영향을 미치는 주요 약물유전체를 알아보면, 예를 들어 텍스트로메트로판 (dextromethorphan)을 투여 후 텍스트로메트로판 및 그 세 가지 대사체인 dextrorphan(DX), 3-methoxymorphinan(MM), 3-hydroxymorphinan(HM)의 혈중농도를 비교하여 본 결과 CYP2D6 와 CYP3A4에 선택적으로 대사되는 dextrorphan 및 3-methoxymorphinan의 경우 그 대사기능이 약한 집단(poor metabolizer, PM)에서 현저히 혈중농도가 높이 관찰되는 것을 알 수 있다. 이러한 약물유전체의 변화로 인한 혈중농도 및 체내동태의 양상이 변하는 현상은 그 약물의 약효 및 독성과 밀접한 관계를 나타날 수 있으므로 주의해야 한다.
일반적으로 약물유전체 군을 분류할 때 그 대사 기능 정도에 따라서 약물을 대사 및 배설하는 기능이 없거나 낮은 대사저하군, 대사 기능이 감소된 활성을 가진 유전자와 정상 유전자가 섞여 있는 중간적인 대사 기능을 보이는 그룹(Intermediate metabolizer, lM), 일반적인 강한 대사능력을 보이는 그룹(Extensive metabolizer, EM), 그리고 일반인보다 그 대사 기능이 더욱 증가된 활성대사자 그룹(UIπa-rapid metabolizer, UM)으로 분류하여 체내동태를 파악하고 그에 따른 약물용량 설정 및 개인 맞춤처방을 하는 것을 목표로 하며, 새로운 작용점 (target site)의 규명을 포함한 용량설정 및 체내동태 평가 등의 신약개발에의 활용에도 광범위한 응용이 가능하다.
특히, 이렇게 CYP450 약물대사효소의 약물유전체 다양성에 의해서 정상적인 대사작용을 보이는 대사활성 (EM) 환자에서는 그 약물대사효소의 기질인 약물을 반복 투여했을 때 정상적인 혈중농도곡선 양상을 보이는 반면, 대사기능저하(PM) 환자에서는 동일 약물을 반복 투여했을 때 약물농도가 축적이 되는 현상을 보일 수 있으므로 독성에 노출될 가능성이 높아지므로 주의해야 한다.
5. 체내동태의 임상적 의의 및 향후 전망
5.1 임상약물동태의 기본 개념
임상약물동태의 해석은 동물실험을 통하여 임상시험을 수행하는 약물신약의 사람에서의 체내동태 양상을 프로파일링 하고 신약허가 이후 개개의 환자에서 약물의 치료적 사용에 있어서 환자에서의 체내동태를 파악하기 위하여 체내동태학의 임상적 의미를 고려하기 위함이다. 즉, 임상약물동태 해석의 주된 적용 목적은 환자의 약물치료요법에 있어서 유효성(약효)을 극대화하고 안전성(독성 및 부작용)을 최소화하는데 있다고 할 수 있다.
따라서 실험동물모델을 이용한 체내동태 데이터를 최대한 활용하여 사람에서의 체내동태를 예측하고 평가하는 시험들이 주를 이룬다. 특히, 실험동물모델에 비해서 약물의 효과를 직접적으로 반영하는 작용부위에서의 약물농도를 모니터링 하는 것이 더욱더 어려우므로 일반적인 혈액 중 농도와 작용부위 조직 중 농도와의 비례적 상관관계를 바탕으로 약동력학적 해석을 할 수 있다.
신약의 임상약물동태 특정을 파악하고 유효한 약효를 보여주는 적절한 혈중농도를 유지시켜주기 위해서 약물의 용량, 투여경로, 투여횟수 등의 용량설정 (dose regimen)과정을 거쳐 얼마의 양(투여용량)을, 얼마나 자주(투여간격), 얼마의 기간 동안(투여기간), 어떠한 방법으로(투여경로) 선택 약물을 사용할 것인가를 약물의 체내동태 특성을 통해 결정하기 위해서 신약과 시판 의약품의 임상약물동태해석은 꼭 필요하다.
5.2 임상시험 과정에서의 체내동태 평가 및 의미
임상과정에서의 약물투여는 실험동물에서와 같이 단회투여도 사용하지만 반복투여 후의 체내동태 양상도 중요하게 평가되고 있다. 주로 임상 1상까지는 단회투여를 위주로 시험하고 2상부터는 반복투여 과정이 필수적으로 필요하다. 적절한 용량보다 과량 반복투여시에는 과도한 약물노출로 부작용 및 독성이 일어날 기능성이 높고 적절한 용량보다 소량 반복투여시에는 효과적인 약효 발현이 일어나지 않을 수도 있으므로 적절한 용량설정과 이의 적절한 반복투여를 했을 경우 장기간의 유효성과 안전성을 함께 조절할 수 있다. 단회투여시의 여러가지 체내동태 파라미터와 더불어서 투여용량, 투여간격 (T) 및 소실반감기에 의해서 결정되는 약물의 축적 정도 파악도 약효와 독성 평가를 위해서 중요하다.
반복투여된 약물이 인체내에 축적되다가 약물이 투여되는 비율과 소실되어 나가는 비율이 비슷하게 되는 평형상태에 도달하게 되고, 이러한 평형상태 도달 후에는 더 이상 축적이 일어나지 않고 최대 또는 최소 약물농도는 지속적으로 유지된다. 이러한 평형상태를 정상상태 (steady-state)라 부르고 투여간격동안 들어간 약물의 양이 같은 시간동안 제거된 약물의 양과 같은 시점을 말하며 이는 전적으로 약물의 소실속도상수(k) 에 따르는 양상이다. 만약 약물의 반감기를 알면 정상상태에 도달하는 시간을 예측할 수 있는데, 반감기의 4배부터 정상상태의 90%를 넘게 되고 (정상상태의 93.75%) 7배부터 정상상태의 99%를 넘는 값(정상상태의 99.25%)으로 기준에 따라 정상상태에 도달할 것이라고 예측할 수 있다.
정상상태에 도달하는 시간은 약물의 소실속도상수 (k)에 의해서 결정되고 그때의 약물농도를 결정짓는 파라미터는 약물의 클리어런스, 분포용적, 약물의 투여용량에 의해서 결정된다. 임상환자의 투여요법 결정에 있어서 중요한 것은 반복투여시 정상상태에서 특정 혈중농도 치료영역에 도달하는 것이다. 혈중농도-시간 곡선의 최고 농도(peak concentration)와 최소 농도(trough concentration) 모두 치료범위 (therapeutic range)에 들어가는 것이 이상적이다.
5.3 신약의 체내동태 평가를 위한 용량 설정
신약의 체내동태 평가는 일반적으로 그 목표에 따라서 약효발현의 경우 약효 용량을, 독성 발현을 평가하기 위해서는 그에 해당되는 독성용량으로 체내동태를 평가한다. 신약의 용량을 설정하기 위해서 가장 중요하게 평가되는 것은 치료농도의 설정이다. 치료영역(therapeutic index)은 어떤 신약이 특정 질병을 치료할 때 매우 안전하고 효과적인 혈중농도 범위를 뜻하며 그 이하의 농도에서는 약효 발현을 관찰하기 힘들고 그 이상의 농도에서는 독성이 나타날 수 있는 범위를 나타낸다. 일반적인 치료영역은 약효를 나타내는 약효용량(EDso; 50% effective dose)와 독성을 나타내는 독성용량(LDso; 50% lethal dose) 사이의 값을 나타낸다. 하지만 독성적 개념을 좀 더 고려하여 일반적인 안전한계 (standard safety margin, SSM)은 다음과 같이 표현되어 진다.

여기 에서 LD1은 시험대상군의 1 %가 사망하는 용량을 말하며 ED99는 99%가 약효가 발현되는 용량을 의미한다. 일반적으로 LD1이 ED99보다 큰 경우는 안전한 것으로 판단할 수 있으나, LD1이 ED99보다 작은 경우에 안전성을 확보하기 위하여 투여용량을 늘리는 것을 주의해야 한다. 실제 임상에서는 치료농도 이하, 치료농도, 독성농도의 엄격한 구분이 힘든 경우가 많고, 환자 개개인의 반응에 따라서 농도범위가 겹치는 영역 (gray area)도 존재하므로 임상에서의 치료영역 설정은 다양한 약동력학적 요소들을 고려하여 설정하는 것이 바람직하다. 신약 및 상용 약물의 경우 치료영역을 최적화하기 위하여 혈중약물농도를 결정하는 치료적 약물농도 모니터링 (therapeutic drug monitoring, TDM)을 통하여 단순히 혈중약물농도를 측정하는 것을 넘어서 체내동태를 해석하고 평가하여 환자 개개인에 알맞은 최적의 약물요법을 찾는 것을 의미한다.
5.4 신약의 임상약물동태 평가를 위한 임상용량 설정
여러 가지 전임상 시험 결과를 바탕으로 임상시험을 위한 신약의 사람에서의 체내동태 양상을 예측하는 것은 신약개발에서 매우 중요한 단계이다. 이러한 사람의 체내동태를 예측하기 위하여 다양한 실험동물에서의 체내동태 결과로부터 파라미터를 변환하여 예측하는 방법 중 가장 일반적인 방법은 알로메트리 (allometry) 혹은 생리학적 (physiologically based) 변환 방법이다. 우선적으로 알로메트리에 의한 변환 방법은 다음과 같은 실험동물 및 사람 종간의 변환식을 이용하여 체내 동태 파라미터를 예측한다.
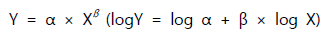
여기에서 Y는 클리어런스나 분포용적 동의 해당되는 체내동태 파라미터를 의미하며, X는 체중과 같은 생리학적 파라미터를 의미한다. 알로메트릭 계수(a)와 알로메트릭 지수(ß)는 위의 식 중 로그변환한 값을 이용하여 그림을 그려보면 기울기와 절편으로부터 구할 수 있다. 사람과 다른 동물종 간의 비교를 위해서 체중 혹은 체표면적을 이용하여 외삽 기법을 적용하여 체내동태 파라미터를 예측할 수 있으며, 이러한 약물용량의 예측 계산 근거에는 생체에서의 약동력학적 특성을 적용하여 단순화시킬 수 있기 때문이다.
일반적으로 동물실험 모델로 많이 이용되는 마우스, 개, 원숭이와 사람의 체중에 따른 용량변환을 위한 클리어런스 비교를 나타낼 수 있다. 보다 정확한 용량 설정을 위해서는 체중보다는 체표면적에 따른 변환이 더 의미가 있을 수 있으며 여러 가지 실험동물 종간의 변환계수를 나타낼 수 있다. 이러한 종간의 변환계수를 통하여 다른 실험동물 종에서의 체내동태 결과를 토대로 사람에서의 체내동태 파라미터를 예측하며 이렇게 예측된 사람에서의 체내동태 파라미터를 근거로 임상용량설정을 위하여 간편하게 이용할 수 있다.
체표면적 에 따른 사람등가용량 (Human Equivalent Dose, HED) 계산식은 다음과 같다. Km 값은 사람 및 동물종에 따라 정해진 값이 있으며 임상시험을 위한 최초투여용량은 최대추천초기투여용량(maximum recommended starting dose, MRSD)을 넘지 않아야 하는데 실험동물모델에서의 반복독성시험 결과 정해지는 무독성용량 (No Observed adverse Effect Level, NOAEL) 및 in vivo 약효시험의 약효용량(Pharmaceutically Active Dose, PAD)을 참조하여 설정한다. 우선
실험동물 종에서의 무독성용량(NOAEL)을 기준으로 적절한 체표면적변환인자(body surface area conversion factor, BSA-CF)를 곱하여 사람등가용량(HED)에 해당하는 사람에서의 예상 무독성용량(NOAEL)을 구한다.
사람에서의 예상 무독성용량 수준에서 사람에서의 최초투여용량이 부작용을 유발하지 않기 위해서는 안전인자(safety factor)가 적용되어야 한다. 이 안전인지를 사용하는 이유는 (1) 사람에서의 사용이 실험동물모델에서 예견된 것보다 약물의 부작용에 더 민감할 수 있고, (2) 종차이에 의한 생체이용률이 달라질 수 있으며, (3) 실험동물 모델에서 인간에서 모든 독성을 평가하지 못했을 수도 있다는 가정 등을 포함하고 있기 때문이다. 일반적으로 사람에게 가능한 최대추천초기투여용량은 사람등가용량에 해당하는 무독성용량을 이 안전인자로 나눈 값으로부터 구한다. 따라서 사람에게 허용될 수 있는 최대추천초기투여용량은 디음과 같은 식으로부터 구하여 용량을 설정한다.
만약 사람등가용량 이 임상시험 가능한 최대추천초기투여용량 보다 적으면 최초의 임상투여용량을 감소시키는 것이 바람직하다.

일반적으로 최대추천초기투여용량(MRSD) 설정을 위한 안전인자로 적어도 10 이상을 고려해야 한다. 물론 높을수록 사람에서의 독성 발현 가능성이 낮아지긴 하겠지만 반면에 약효 발현에 문제가 생길 수도 있으므로 사람등가용량에 해당하는 무독성용량과 약효용량수준을 보고 정하는 것이 바람직하다.
(1) 급격한 용량 반응곡선, (2) 현저한 독성, (3) 모니터링이 불가능하거나 선모니터링 정후가 없는 독성, (4) 실험동물 종간의 다양한 생체이용률, (5) 비가역적인 독성, (6) 이유가 밝혀지지 않는 사망률, (7) 용량이나 혈장 농도의 큰 변화성에 기인한 효과, (8) 선형적이지 않은 체내동태, (9) 부적절한 용량-반응 결과, (10) 새로운 치료적 수용체, (11) 제한된 유용성을 갖는 동물 모델을 사용했을 경우 등의 경우에는 안전인자를 10보다 높이는 것이 바람직하다.
보통 임상 1상 시험을 위하여 최초로 정해지는 사람에서의 투여용량은 실험동물 독성시험에서 관찰되는 LD10 (10%의 동물을 치사시키는 용양)의 1/10에서 초회 용량으로 설정하고 단계적으로 용량을 증가하여 투여한다. 이 과정에서 적절한 임상용량설정 및 임상시험 진행을 위해서는 전임상시험과의 용량적 측면에서의 가교 부분을 고려하여 전임상에서의 최대허용용량의 혈중농도와 임상 l상 시험에서의 최초 투여용량에서의 혈중농도를 종합적으로 고려하여 점차로 용량을 증가하는 방법을 사용하는 것이 바람직하다.
5.5. 신약개발을 위한 체내동태 평가의 향후전망
신약개발 과정에 있어서 체내동태 해석을 위한 좀 더 신속하고 빠르게 하기 위한 HTS 방법과 in silico 방법적인 시도들은 계속 진행될 것이다. 그리고 신약개발단계에서 체내동태를 해석하기 위한 보다 초기단계에서의 예측 기술들이 발달할 것이다. 그 중 형광 탐침자(probe)를 이용한 HTS 기반 CYP450 시험방법과 사람에서의 체내동태를 예측할 수 있는 세포주 기반의 in vitro 스크리닝 기법이 발전할 것이며 특히, 약물대사효소와 약물수송체에 대한 다양한 해석을 하기 위한 특정 단백질이 고발현되거나 유전자재조합을 통한 고발현 실험모델의 등장으로 체내동태 해석을 위한 약물대사효소와 약물수송체에 대한 이해가 높아질 것이다. 또한 체내동태를 기반으로 약효를 반영하기 위한 바이오마커들의 개발과 이용을 위한 많은 시도가 향후에 전망된다. 생리학적 모델을 기반으로 하는 체내동태해석을 통하여 보다 자세한 생리학적인 요인을 감안한 약물치료를 시도할 수 있으며 약물유전체학의 발전으로 환자 개개인에게 맞는 맞춤약물치료를 위한 체내동태해석의 지원도 필요할 것이다.
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 신약개발의 프로세스
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 신약 후보물질의 발굴
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 신약 후보물질의 생산과 품질관리
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 완제 및 원료의약품 GMP
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 비임상 효력시험
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 일반약리시험과 안전성약리시험
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 독성시험 (비임상 안전성평가시험)
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 비임상시험관리기준 (GLP)
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 비임상시험과 임상시험의 연계
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 임상개발 개요
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 임상시험의 과학적 측면
[보건의료/신약개발 과정의 이해] - 후보 물질 발굴과 비임상시험 | 개별 Product level


댓글